Окисление - никель
Cтраница 1
Окисление никеля во всем объеме катализатора и, как следствие, потеря активности последнего могут произойти из-за прекращения или снижения подачи сырья при сохранении подачи водяного пара в реактор. [1]
Окисление никеля при нагревании на воздухе ускоряется уже при добавке 0 15 - 1 54 ат. [2]
Окисление никеля происходит вследствие того, что потенциал положительного электрода при пропускании тока сдвигается в положительную сторону от своей равновесной величины. Таким образом, полезным процессом при электролизе солей никеля является образование никелевого покрытия на отрицательном электроде и растворение никеля, поддерживающее относительное постоянство концентрации ионов Ni 2 в растворе. [3]
Процесс окисления никеля ускоряется при одновременном присутствии едкой щелочи и окислителя с образованием аминонитратных комплексов различного состава, которые претерпевают значительные изменения. [4]
В случае окисления никеля, так же как и в некоторых других случаях, эта реакция лимитирована процессом диффузии, происходящей в плотном слое окисла, покрывающего металл. [5]
В случае окисления никеля, нанесенного на глиноземный носитель, в рабочих условиях катализатора конверсии метана при значительном избытке глинозема легко протекает реакция образования каталитически неактивной шпинели NiO - Al2O3 [5]: NiO 13Al2O3 - - NiO - 13A12O3, что является одной из причин снижения активности катализатора. [6]
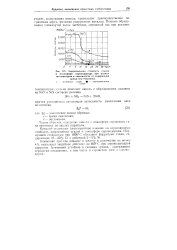 |
Коррозионная стойкость сталей. [7] |
Таким образом, окисление никеля в атмосфере сернистого газа протекает по закону параболы. [8]
Если сопоставить скорость окисления никеля, меди и железа при 900, то для никеля эта величина ( по привесу) оказывается равной 7 6 10 - 7 г / см2 - час, для меди - 12 7 10 - 5 г. см2 - час и для железа - 6 5 10 - 4 г / см2 - час. [9]
При изучении кинетики окисления никеля установлено, что скорость окисления возрастает с увеличением давления кислорода. [10]
При обыкновенной температуре на воздухе окисление никеля идет медленно, кобальта и железа быстрее. Будучи накаленными, они сгорают, образуя оксиды Fe2Os, CoO, NiO. Железо образует также оксиды FeO, РезО4 и FeOs. [11]
При обыкновенной температуре на воздухе окисление никеля идет медленно, кобальта и железа быстрее. Будучи накаленными, они сгорают, образуя оксиды Fez03, СоО, NiO. Железо образует также оксиды FeO, FesC4 и РеОз. [12]
Механизм процесса и истинное состояние окисления никеля в окисленной форме не вполне понятны. [13]
НДМГ) 2, затем для окисления никеля экстракт встряхивают с бромной водой и снова определяют никель в водной фазе в виде хелата Niiv. Экстракцию № ( НДМГ) 2 часто используют также для предварительного отделения и концентрирования никеля перед его определением при помощи других реагентов. [14]
По данным Эка [11], реакция окисления никеля тормозится выпадающим осадком каломели и металлической ртути. [15]
Страницы: 1 2 3 4