Окисление - сероводород
Cтраница 1
Окисление сероводорода в крови происходит очень быстро. До 99 %, сероводорода удаляется из организма в течение 3 - 5 мин. Поэтому его обнаруживают в крови лишь в том случае, если скорость поступления H2S равна скорости-окисления или превышает последнюю. [1]
Окисление сероводорода на железооксидных катализаторах при температуре 225 - 300 С и объемной скорости до 15000 ч 1 характеризуется конверсией сероводорода 95 - 100 % при селективности образования элементной серы 95 - 99 %: При этих температурах образующаяся сера не отлагается на поверхности катализатора, а выводится из реакционной зоны в газообразном виде. Процесс рекомендуется проводить при малом времени контакта с тем, чтобы предотвратить или снизить образование высокомолекулярной серы St и Sr Уменьшение времени контакта способствует также повышению селективности процесса за счет снижения степени превращения сероводорода в диоксид серы в результате последовательной реакции доокисления образующейся серы. [2]
 |
Схема отделения конденсации серной кислоты. [3] |
Окисление сероводорода происходит на насадке из природного боксита, являющегося катализатором. Окисление сернистого ангидрида в серный достигается в контактном аппарате с промежуточным теплообменом, на полках которого находится ванадиевая контактная масса. [4]
Окисление сероводорода, серы и восстановленных ее соединений производится весьма разнообразными микроорганизмами. В слабой степени подобные процессы могут вызываться обычными сапрофитными бактериями ( например, Вас. [5]
Окисление сероводорода в водоемах происходит при участии особых видов микрофлоры - серобактерий. Серобактерии в изобилии населяют любой водный источник, в котором выделяется сероводород. Пушистыми массами белого или пурпурового цвета они нередко устилают все дно водоемов. Есть среди них виды, обладающие органами движения, есть и виды, лишенные движения, но все эти виды объединяет одно: сероводород для них не яд, а питательное вещество, без которого они не могут существовать. [6]
Окисление сероводорода осуществляется в два этапа. К серобактериям, окисляющим сероводород через образование свободной серы, относятся бесцветные и пурпурные серобактерии. Из бесцветных серобактерий чаще всего встречается Beggiatoa alba. [7]
Окисление сероводорода производится серобактериями, которые подразделяются на бесцветные и пурпурные. Бесцветные серобактерии являются строгими аэробами. Многие из них имеют нитчатую форму тела, длина которого достигает 10 мм. Наиболее типичными представителями нитчатых серобактерий является Beggiatoa и Thioploca. Эти микроорганизмы относятся к автотрофам: единственным источником углерода, который они используют, служит углекислота. Необходимую для связывания углекислоты энергию они получают путем окисления сероводорода кислородом воздуха: 2H2S O22H2O S2 Q кал. Таким образом, бесцветные серобактерии являются типичными хемо-синтетиками. [8]
 |
Схема печного отделения для сжигания концентрированного сероводородного газа. [9] |
Окисление сероводорода в печи происходит на поверхности насадки из природного боксита. Образующийся в результате сжигания Н25 сернистый ангидрид при 600 С направляется в теплообменник, где охлаждается до 4 - 0 - 480 С и далее передается в контактный аппарат. Для поддержания устойчивого процесса горения в печь через горелку постоянно подается небольшое количество горючего газа. [10]
 |
Схема производства серной кислоты из сероводородного газа низкой. [11] |
Окисление сероводорода в печи происходит на насадке из природного боксита, являющегося катализатором этого процесса. Окисление сернистого ангидрида в серный проводится в контактном аппарате 4 с промежуточным теплообменом; на полках аппарата находится ванадиевая контактная масса. [12]
Окисление сероводорода хлорной или бромной водой протекает по двум направлениям в зависимости от условий реакции. [13]
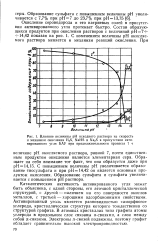 |
Влияние величины рН исходного раствора на скорость и механизм окисления H2S, NaHS и Na2S в присутствии активированного угля БАУ при продолжительности процесса 1 ч. [14] |
Окисление сероводорода и его натриевых солей в присутствии активированного угля протекает быстро. С изменением величины рН окисляемого раствора меняется и механизм реакций окисления. [15]
Страницы: 1 2 3 4