Окисление - триптофан
Cтраница 1
Окисление триптофана начинается с реакции, катализируемой ферментом тринтофанпирролазой. Этот фермент, в простетическую группу которого входит железопротопорфирин IX ( см. гл. VIII), осуществляет превращение триптофана в L-N - формилкинурепин с использованием молекулярного кислорода в качестве окислителя. Тринтофаштирролаза - индуцибелышй фермент, содержание которого в тканях млекопитающих повышается при скармливании триптофана, а-метилтриптофана или глюкокортикоидов. [1]
Окисление триптофана в формилкинуренин происходит с участием О2 и Н2О2; каталаза [737-739] тормозит этот процесс. [2]
Предполагают, что процесс окисления триптофана трипто-фанпероксидазой протекает с образованием промежуточного соединения, природа которого еще не известна. [3]
Исчерпывающие исследования Виткопа и его сотрудников [304, 312] обещают внести важный вклад в разрешение проблемы о механизме окисления триптофана в кинуренин. [4]
Chromobacterium violaceum легко выделить из почвы, если положить зерна риса в чашку Петри на сильно увлажненную почву; колонии этого микроорганизма легко узнать по сине-фиолетовой окраске, обусловленной нерастворимым в воде пурпурным пигментом виолацеи-ном. Этот пигмент представляет собой производное индола, образующееся при окислении триптофана. [5]
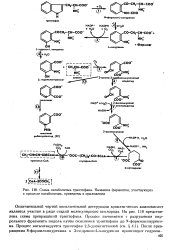 |
Схема катаболизма триптофана. Названия ферментов, участвующих в процессе катаболизма, приведены в приложении. [6] |
Отличительной чертой окислительной деструкции ароматических аминокислот является участие в ряде стадий молекулярного кислорода. На рис. 118 представлена схема превращений триптофана. Процесс начинается с разрушения пир-рольного фрагмента индола путем окисления триптофана до N-формилкинурени-на. [7]
Нокс и Мелер [307] получили из печени некоторых видов животных растворимую систему ферментов, превращающую / - триптофан в кинуренин и муравьиную кислоту. Эта растворимая система ферментов может быть разделена на окислительную систему, осуществляющую две окислительные реакции, и на гидролитический фермент - форми-лазу. Формилкинуренин был получен озонированием триптофана; найдено, что он идентичен с промежуточным соединением, которое накапливается в отсутствие формилазы при окислении триптофана ферментами печени. [8]
Присутствие различных продуктов обмена триптофана в моче больных при некоторых заболеваниях может стоять в прямой связи со специфическим патологическим процессом; однако могут быть выдвинуты и другие объяснения. Например, выделение таких метаболитов может представлять собой вторичное явление, зависящее от изменения функции почек или от нарушения нормальных соотношений между различными аминокислотами в промежуточном обмене веществ. Возможно также, что полученные данные в какой-то степени связаны с повышенной интенсивностью распада триптофана. Обнаружено, что активность триптофанпероксидазы в печени может подвергаться быстрым и резким адаптивным изменениям и зависит от влияния определенных эндокринных воздействий. В свете этих данных возможно, что выделение продуктов распада триптофана с мочой является следствием повышенной интенсивности процесса окисления триптофана в кинуренин. [9]
Количество этого фермента в печени крыс можно повысить, добавляя им в пищу L-триптофан. Выделенный белок не проявляет ферментативной активности по отношению к L-триптофану, если в реакционную смесь не добавить какой-нибудь восстановитель, например аскорбиновую кислоту. Этот процесс, как было показано, состоит из двух стадий. Во-первых, неактивный фермент ( апофер-мент) должен соединиться со своей простети-ческой группой, гематином, образуя голофер-мент. Для этой реакции необходим триптофан ( или его аналог), так же как и источник гема-тина, такой, как метгемоглобин. Во-вторых, голофермент образуется в окисленной форме и должен быть восстановлен, чтобы осуществлять окисление триптофана. [10]
Страницы: 1