Окисление - трехвалентный хром
Cтраница 2
Была проверена также возможность окисления трехвалентного хрома д о шестивалентного с помощью большой поверхности анода и малой поверхности катода электрическим током, но, как показал опыт, этот процесс проходит чересчур медленно. Поскольку описанные способы оказались неэффективными, до сих пор для регенерации травильного раствора в него добавляют необходимое количество бихромата. [16]
Кроме указанного способа, для окисления трехвалентного хрома рекомендуется поместить в ванну для электрополирования дополнительный свинцовый анод, подключенный через дополнительное сопротивление, примерно 0 5 см, что позволяет значительно дольше эксплуатировать электролит без окисления трехвалентного хрома. Схема включения дополнительного анода приведена на фиг. [17]
Регенерация хромсодержащих растворов заключается в окислении трехвалентного хрома до шестивалентного, удалении примесей посторонних ионов и корректировке по содержанию основных компонентов. Высокая агрессивность растворов на основе шестивалентного хрома создает дополнительные трудности при применении таких регенерационных способов, как ионный обмен, электродиализ и реагентный метод. Эта же причина усложняет обезвреживание концентрированных хромсодержащих растворов. [18]
На аноде при этом протекают окислительные процессы: окисление трехвалентного хрома до шестивалентного и выделение кислорода. [19]
 |
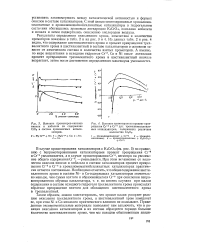
Влияние добавки серной кислоты на ход катодных поляризационных. [20] |
На нерастворимом свинцовом аноде при электролизе происходит выделение кислорода и активное окисление трехвалентного хрома до шестивалентного. [21]
 |
Влияние промоторов-окислов.| Влияние промоторов на процент прев. [22] |
Таким образом, можно констатировать, что хромат калия ускоряет реакцию окисления трехвалентного хрома, а шестивалентный хром замедляет ее, при этом Ni и Со никакого практического влияния не оказывают. [23]
Свинец, применяемый в качестве анода, имеет большое значение в процессе окисления трехвалентного хрома в шестивалентный. Выяснено, что свинец действует как катализатор благодаря образованию на его поверхности двуокиси свинца, играющей роль передатчика кислорода. [24]
В процессе электролиза свинцовые аноды покрываются слоем диоксида свинца РЮ2, который катализирует окисление трехвалентного хрома и защищает свинец от дальнейшего разрушения. При поддержании определенного соотношения анодной и катодной плотностей тока можно установить равновесие, при котором на аноде будет окисляться такое же количество трехвалентного хром: а, которое попадает в электролит из катодной зоны. Чем больше анодная поверхность и, следовательно, чем меньше анодная плотность тока, тем с большим выходом по току окисляется трехвалентный хром. [25]
В процессе электролиза свинцовые аноды покрываются слоем диоксида свинца РЮ2, который катализирует окисление трехвалентного хрома и защищает свинец от дальнейшего разрушения. При поддержании определенного соотношения анодной и катодной плотностей тока можно установить равновесие, при котором на аноде будет окисляться такое же количество трехвалентного хрома, которое попадает в электролит из катодной зоны. Чем больше анодная поверхность и, следовательно, чем меньше анодная плотность тока, тем с большим выходом по току окисляется трехвалентный хром. [26]
В процессе электролиза свинцовые аноды покрываются слоем двуокиси свинца РЬОг, которая катализирует окисление трехвалентного хрома и защищает свинец от дальнейшего разрушения. [27]
Наиболее подходящим материалом для изготовления анодов является свинец, на поверхности которого облегчен процесс окисления трехвалентного хрома в шестивалентный. Одновременно на поверхности анода идет разряд ионов гидроксила и выделение кислорода. В процессе электролиза на поверхности анодов образуется темно-коричневая пленка пероксида свинца, которая обеспечивает более однородное состояние поверхности анодов и улучшает их работу. [28]
В процессе электролиза их поверхность покрывается слоем перекиси свинца РЬО2, которая является катализатором процесса окисления трехвалентного хрома, а также защищает свинец от дальнейшего разрушения. При определенном соотношении анодной и катодной плотностей тока можно установить равновесие, при котором на аноде окисляется такое же количество трехвалентного хрома, какое попадает в электролит из катодной зоны. Чем больше анодная поверхность ( и, следовательно, чем меньше анодная плотность тока), тем с большим выходом по току окисляется трехвалентный хром. [29]
Миллс и Герман17 предложили метод для определения хрома в алюминиевых сплавах, который основан на окислении трехвалентного хрома в шестивалентный и получении волны последнего на фоне гидроокиси натрия. [30]
Страницы: 1 2 3 4