Контактное окисление - двуокись - сера
Cтраница 1
Контактное окисление двуокиси серы является типичным примером гетерогенного окислительного экзотермического катализа. [1]
Контактное окисление двуокиси серы является типичным примером гетерогенного, окислительного, экзотермического катализа. [2]
Вычисленная выше величина скорости контактного окисления двуокиси серы, при которой значительно сказывается влияние переноса к внешней поверхности зерен, справедлива лишь для значения критерия Рейнольдса дг200, отвечающего производственным условиям. При лабораторных исследованиях каталитической активности линейные скорости газа значительно меньше, чем в производственных условиях. [3]
Вычисленная выше величина скорости контактного окисления двуокиси серы, при которой значительно сказывается влияние переноса к внешней поверхности зерен, справедлива лишь для значения критерия Рейнольдса г2 0, отвечающего производственным условиям. При лабораторных исследованиях каталитической активности линейные скорости газа значительно меньше, чем в производственных условиях. Соответственно уменьшаются значения критерия Рейнольдса, и лимитирующее влияние прсцгссов переноса к внешней поверхности должно сказываться при величине скорости реакции, меньшей 0 7 кг-мол / м2 час. [4]
 |
Схема установки для окисления двуокиси серы в кипящем слое катализатора. [5] |
В данной работе следует определить оптимальные условия контактного окисления двуокиси серы. [6]
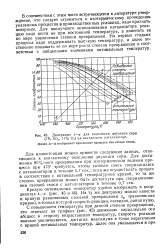 |
Диаграмма t - к для окисления двуокиси серы ( 7 % SO2, 11 % О2 на ванадиевом катализаторе. [7] |
Для иллюстрации можно привести следующие данные, относящиеся к контактному окислению двуокиси серы. Для достижения 90 % - ного превращения при изотермическом ведении процесса при 475 требуется, чтобы газовая смесь соприкасалась с катализатором в течение 1 7 сек. [8]
Это кинетическое уравнение логически вытекает из определенных представлений о механизме контактного окисления двуокиси серы на платине, а именно из предположения, что лимитирующим этапом процесса является адсорбция двуокиси серы на поверхности платины, покрытой кислородом. Возможно, что эта адсорбция непосредственно приводит к образованию на поверхности катализатора трехокиси серы. Остальные этапы - отщепление трехокиси серы и адсорбция кислорода-осуществляются настолько быстро, что концентрация адсорбированных молекул двуокиси серы на поверхности оказывается близкой к равновесной по отнсшэнию к концентрации трехокиси серы и кислорода в газовой фазе. Замедляющее влияние трехокиси серы на скорость прямой реакции объясняется увеличением доли поверхности, занятой двуокисью серы, с ростом концентрации трехокиси серы в газовой фазе. Скорости образования и разложения трехокиси серы рассматриваются как разности скоростей прямой и обратной реакции. [9]
Это кинетическое уравнение логически вытекает1 из определен-1 ных представлений о механизме контактного окисления двуокиси серы на платине, а именно из предположения, что лимитирующим этапом процесса является адсорбция двуокиси серы на поверхности платины, покрытой кислородом. Возможно, что эта адсорбция непосредственно приводит к образованию на поверхности катализатора трехокиси серы. Остальные этапы - отщепление трехокиси серы и адсорбция кислорода-осуществляются настолько быстро, что концентрация адсорбированных молекул двуокиси серы на поверхности оказывается близкой к равновесной по отношению к концентрации трехокиси серы и кислорода в газовой фазе. Замедляющее влияние трехокиси серы на скорость прямой реакции объясняется увеличением доли поверхности, занятой двуокисью серы, с ростом концентрации трехокиси серы в газовой фазе. Скорости образования и разложения трехокиси серы рассматриваются как разности скоростей прямой и обратной реакции. [10]
Кроме того, из опытов Тэйлора и Ленера следует, что молекулярность контактного окисления двуокиси серы на платине равна единице, в то время как если бы лимитирующей являлась первая стадия, молекулярность должна была бы равняться двум. [11]
Сероводород вызывает отравление платиновых катализаторов при окислении аммиака и при многих других каталитических реакциях. Данных о вредном влиянии сероводорода на платиновые катализаторы в условиях контактного окисления двуокиси серы не имеется. [12]
Упомянутые особенности процессов химической адсорбции и, главным образом, совпадение температурных областей химической адсорбции и каталитической активности позволили ряду исследователей предположить, что химическая адсорбция и является той стадией каталитического процесса, которая приводит молекулы реагирующих веществ в деформированное состояние, обусловливающее снижение энергии активации. Так, например, некоторые исследователи предполагают, что при контактном окислении двуокиси серы на платине происходит химическая адсорбция кислорода, диссоциирующего при этом на отдельные атомы, с которыми и реагируют молекулы двуокиси серы из газовой фазы. [13]
Такое предположение подкрепляется тем, что скорость адсорбции кислорода на платине велика и значительно превышает скорость окисления двуокиси серы. Кроме того, из опытов Тэйлора и Ленера следует, что молекулярность контактного окисления двуокиси серы на платине равна единице, в то время как если бы лимитирующей являлась первая стадия, молекулярность должна была бы равняться двум. [14]
Одновременно с ростом объема производства серной кислоты в СССР достигнуты значительные успехи по улучшению ряда производственных процессов. Так, например, интенсивность башенных систем повышена в 10 раз, интенсивность обжиговых печей повышена в 2 раза, разработаны и освоены новые конструкции аппаратов башенного и контактного способа производства и др. Широко развернута научно-исследовательская работа по совершенствованию и интенсификации производства, направленная на дальнейшее повышение выпуска серной кислоты для нашего народного хозяйства. В многих теоретических вопросах, связанных с производством серной кислоты ( контактное окисление двуокиси серы, кинетика нитрозного процесса, обжиг сернистого сырья и др.), советские исследователи идут впереди зарубежной науки. В рационализации производства активно участвуют широкие массы инженерно-технических работников заводов и рабочих-производственников. [15]
Страницы: 1