Электрохимическое окисление - водород
Cтраница 1
Электрохимическое окисление водорода на аноде вызывает соответствующее уменьшение выхода кислорода по току. Загрязнение кислорода отдуваемым из электролита и проникающим через диафрагму водородом приводит к потере выхода кислорода по току, так как в процессе очистки кислорода от примесей водорода ( путем выжигания) часть кислорода расходуется на взаимодействие с водородом. Если электролиз происходит при атмосферном давлении, растворимость газов в электролите невелика и указанные процессы имеют обычно небольшое значение. При электролизе под давлением значение их существенно возрастает. [1]
Скорость электрохимического окисления водорода на платине и сплавах платины с палладием сильно зависит от природы носителя. [3]
Методика, основанная на электрохимическом окислении водорода, диффундирующего через тонкую металлическую мембрану, позволяет непосредственно изучить влияние режима хро - мирования, состава электролита, состояния поверхности стали и других факторов на водородопроницаемость стали, а следователью, на ее наводороживание. [5]
Методика, основанная на электрохимическом окислении водорода, диффундирующего через тонкую металлическую мембрану, позволяет непосредственно изучить влияние режима хро-мирования, состава электролита, состояния поверхности стали и других факторов на водородопроницаемость стали, а следователью, на ее наводороживание. [7]
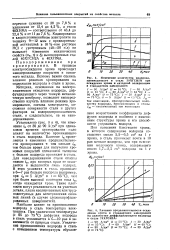 |
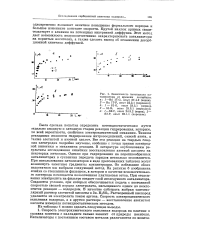
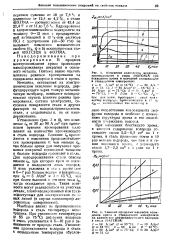
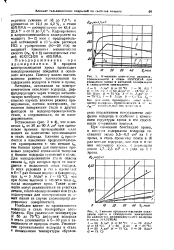
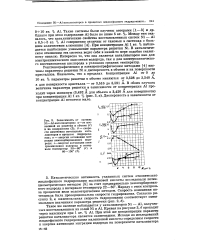
Изменение количества водорода, проникающего в сталь ЗОХГСН2А при осаждении хрома и катодной поляризации в стандартном электролите. [8] |
Методика, основанная на электрохимическом окислении водорода, диффундирующего через тонкую металлическую мембрану, позволяет непосредственно изучить влияние режима хромирования, состава электролита, состояния поверхности стали и других факторов на водородопроницземость стали, а следовательно, на ее наводороживание. [9]
В качестве катиона в случае полимера II выступает метил-дипиридил-медиатор транспорта электрона, детально исследованный при изучении ферментативного электрохимического окисления водорода. [10]
Оба эти процесса, связанные с потерей полученного водорода, приводят к снижению его выхода по току. Электрохимическое окисление водорода на аноде приводит к соответствующему снижению выхода кислорода по току. Загрязнение кислорода отдуваемым из электролита водородом также надо рассматривать как снижение выхода Ог по току, так как при очистке кислорода от примесей водорода, обычно проводимой путем выжигания Н2, расходуется соответствующее количество кислорода. [11]
Нулевой порядок реакции можно объяснить, приняв, что в электрохимическом процессе участвует только активная часть поверхности, на которой скорость адсорбции Н2 достигает достаточной величины. На активной части поверхности имеет место адсорбционное равновесие с молекулярным водородом, соответствующее значительному заполнению, а скорость суммарного процесса определяется скоростью некоторой стадии, следующей за адсорбцией, например скоростью ионизации адсорбированного водорода или поверхностной диффузией атомов от центров, на которых происходит адсорбция, к центрам, на которых происходит ионизация. Таким образом, порядок реакции электрохимического окисления водорода зависит в основном от соотношения между скоростями различных стадий процесса. [12]
Для осуществления р О необходимо выполнение двух условий: во-первых, замедленность одной из стадий, следующих за адсорбцией, во-вторых, степень заполнения активной части поверхности должна быть близка к. Нулевой порядок реакции можно объяснить, приняв, что в электрохимическом процессе участвует только активная часть поверхности, на которой скорость адсорбции Н2 достигает достаточной величины. На активной части поверхности имеет место адсорбционное равновесие с молекулярным водородом, соответствующее значительному заполнению, а скорость суммарного процесса определяется скоростью некоторой стадии, следующей за адсорбцией, например скоростью ионизации адсорбированного водорода или поверхностной диффузией атомов от центров, на которых происходит адсорбция, к центрам, на которых происходит ионизация. Таким образом, порядок реакции электрохимического окисления водорода зависит в основном от соотношения между скоростями различных стадий процесса. [13]
Такие системы были изучены авторами [1-3] и др. Однако при этом содержание А1 было не ниже 5 ат. В каталитическом отношении эта система ведет себя в какой-то мере подобно скелетному никелю. Интересно то, что она является катализатором как для электрохимического окисления водорода, так и для электрохимического восстановления кислорода в условиях средних температур. [15]
Страницы: 1