Дальнейшее окисление - окись - азот
Cтраница 1
 |
Принципиальная схема производства азотной кислоты. [1] |
Дальнейшее окисление окиси азота осуществляется одновременно с образованием азотной кислоты [ реакция ( XII. Отходящие газы подвергаются очистке ( 6), после чего выводятся в атмосферу. [2]
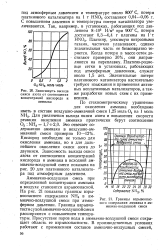 |
Зависимость выхода.| Границы взрывоопасного содержания аммиака в аммиачно-воздушнои смеси. [3] |
Кислород необходим не только для окисления аммиака, но и для дальнейшего окисления окиси азота до двуокиси. Зависимость выхода окиси азота от соотношения концентраций кислорода и аммиака в исходной аммиачно-воздушнои смеси показана на рис. 20 для платинового катализатора под атмосферным давлением. [4]
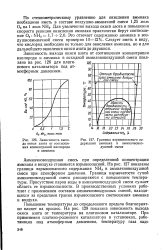 |
Зависимость выхода окиси азота от соотношения концентраций кислорода и аммиака.| Границы взрывоопасного содержания аммиака в аммиачновоздушной смеси. [5] |
Следует иметь в виду, что кислород необходим не только для окисления аммиака, но и для дальнейшего окисления окиси азота до двуокиси. [6]
В холодильнике-конденсаторе / происходит охлаждение газа, частичное окисление окиси азота, конденсация паров воды и образование слабой азотной кислоты. В окислительной колонне 4 происходит дальнейшее окисление окиси азота. В доокислителе 5 остатки окиси азота окисляются концентрированной азотной кислотой. [7]
По стехиометрическому уравнению для окисления аммиака необходимо иметь в составе воздушно-аммиачной смеси 1 25 моля О2 на 1 моль ЫНз. Следует иметь в виду, что кислород необходим не только для окисления аммиака, но и на дальнейшее окисление окиси азота до двуокиси. [8]
Согласно лабораторным и заводским данным для получения хороших выходов NO необходимо иметь в исходной аммиачно-воздушной смеси 1 7 - 2 объема кислорода на 1 объем аммиака. При этих условиях кислорода хватает и на дальнейшее окисление окиси азота до азотной кислоты и не приходится добавлять воздух или кислород в абсорбционную систему. [9]
 |
Принципиальная схема контактного аппарата для производства азотной кислоты под атмосферным давлением. [10] |
По реакции окисления аммиака до окиси азота на 4 молекулы аммиака теоретически необходимо затратить 5 молекул кислорода или на 1 моль аммиака 1 25 моль кислорода. Для увеличения выхода окиси азота и повышения скорости реакции окисления аммиака практически берут на 1 моль аммиака 1 7 - 2 моль кислорода. Указанному отношению отвечает содержание примерно 10 - 12 % аммиака в исходной аммиачно-воздушной смеси. Кислород необходим не только для окисления аммиака, но и на дальнейшее окисление окиси азота до двуокиси. [11]
Для регулирования температуры воздуха, поступающего в смеситель, теплообменник 4 имеет байпас. Горячие нитроз-ные газы проходят теплообменник 4, где охлаждаются до 450 и лоступают в водяной холодильник-конденсатор 13, где охлаждаются до 40 С. Окисление NO в МО2 в конденсаторе протекает быстро, так как газы находятся под давлением. Нитрозные тазы из конденсатора 13 поступают в колонну 14, где происходит дальнейшее окисление окиси азота и взаимодействие двуокиси азота с водой. Поглотительные колонны конструируют с колпачковыми или ситчатыми барботажными тарелками. Для отвода тепла реакции служат змеевиковые холодильники, расположенные на тарелках колонны. Конденсатор и колонна изготавливаются из хромоникелевой стали. [12]
Молекула N02 имеет нечетное число внешних электронов, парамагнитна. Вопрос об электронной структуре молекул N02 и N2O4 окончательно не решен. Четырехокись N2O4 с жидким аммиаком реагирует со взрывом. В пром-сти двуокись азота получают как промежуточный продукт в произ-ве азотной к-ты дальнейшим окислением окиси азота кислородом или воздухом; в лаборатории - разложением Pb ( NO3) 2 или взаимодействием меди с конц. [13]
Молекула МО2 имеет нечетное число внешних электронов, парамагнитна. Вопрос об электронной структуре молекул М02 и М204 окончательно не решен. Четырехокись N2O4 с жидким аммиаком реагирует со взрывом. В пром-сти двуокись азота получают как промежуточный продукт в произ-вэ азотной к-ты дальнейшим окислением окиси азота кислородом или воздухом; в лаборатории - разложением РЬ ( МО3) 2 или взаимодействием меди с конц. [14]
Страницы: 1