Окись - калий
Cтраница 3
Гидрат окиси калия ( едкое кали КОН) - белое кристаллическое вещество, быстро расплывающееся на воздухе. По действию на человека сходен с каустической содой. [31]
Гидрат окиси калия КЙ, смешанный с избытком воды, выделяет от 303 до 340 на эквивалент калия. Это число, даже не будучи точным, дает уже положительный ответ, тем более, что это - первый атом воды, который выделяет наибольшее количество тепла. Окись калия выделяет, следовательно, значительно больше тепла, чем известь, причем первая является также наиболее сильной. [32]
Гидрат окиси калия КОН см. Едкое кали. [33]
При нагревании окись калия реагирует также с фтором, хлором, иодом и серой. [34]
Если концентрация окиси калия или окиси натрия выше 0 100 мг / мл, то пробу разбавляют в два раза и соответственно вдвое увеличивают результат. [35]
Иногда содержание окиси калия достигает 10 - 15 %, и тогда цементная пыль применяется как калийное удобрение. [36]
К гидрату окиси калия, применяемому для приготовления электролита щелочных аккумуляторов, предъявляются жесткие требования в отношении содержания в нем примесей. Особенно нежелательно присутствие карбонатов, сульфатов и ряда металлов, более электроположительных, чем железо. [37]
Жидкий гидрат окиси калия транспортируют в железнодорожных цистернах, стальных контейнерах, предназначенных для перевозки едких жидкостей и в стальных бочках. [38]
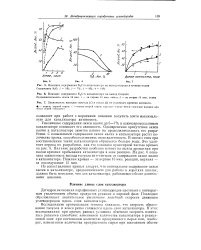
Увеличение содержания окиси калия до 5 - 7 % в алюмохромокалиевом катализаторе повышает его активность. Одновременно присутствие окиси калия в катализаторе заметно влияет на продолжительность его разработки. С повышением содержания окиси калия в катализаторе растет количество хрома, способного изменять свою валентность. В связи с этим при восстановлении таких катализаторов образуется больше воды. Явление разработки особенно влияет на выход ароматики при малом времени пребывания катализатора в зоне реакции. На рис. 6 показана зависимость выхода толуола из н-гептана от содержания окиси калия в катализаторе. Нижняя кривая - за первые 15 мин. [40]
При условиях катализа окись калия превращается в K2S2O7, а контактная масса в общем представляет собой пористый носитель, поверхность и поры которого смочены пленкой раствора пятиокиси ванадия в жидком пиросульфате калия. [41]
При условиях катализа окись калия превращается в KsSgO. [42]
Известны К2О - окись калия, К2О2 - диоксид калия, К3О4 - тетраоксид калия; последние два вещества относятся к типу перекисей. При сжигании калия в кислороде образуется смесь всех трех окислов. [43]
 |
Значение калия для сельского хозяйства. [44] |
Одновременно образуется и окись калия. Калий непосредственно соединяется, особенно при нагревании, с галогенами, серой и другими неметаллами. [45]
Страницы: 1 2 3 4