Окись - самарий
Cтраница 2
Таким образом, был хроматографически зафиксирован процесс обратимой и необратимой активированной адсорбции, полученный для различных кислот на окиси самария. [16]
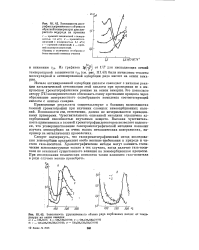 |
Зависимость логарифма удерживаемого объема от обратной температуры для хлористого водорода на кремнии.| Зависимость удерживаемого объема ряда карбоновых кислот от температуры на окиси самария. [17] |
Начало активированной адсорбции кислоты совпадает с началом реакции каталитической кетонизации этой кислоты при проведении ее в импульсном хроматографическом режиме на окиси самария. Это позволило автору [74] экспериментально обосновать схему протекания процесса через образование поверхностного солеобразного комплекса соответствующей кислоты с окисью самария. [18]
Характер полученных данных свидетельствует о том, что для всех изученных веществ в указанных диапазонах температур наблюдалась физическая адсорбция спиртов на окиси самария. [19]
Чувствительность метода в растворе составляет: 0 008 о для окиси празеодима; 0 008 % для окиси неодима и 0 03 % для окиси самария. [20]
Ашар [22] показал, что для некоторых окислов РЗЭ заметная потеря веса наблюдается при относительно низких температурах: для окиси европия 1100 С, для окиси самария 1130 С, для окисей иттербия и тулия - 1200 С. [21]
При спектральном исследовании на загрязнение окислами редкоземельных металлов обнаружено ( в г): окиси иттрия - менее 0 0001; окиси лантана - менее 0 0001; окиси иттербия - менее 0 0001; окиси самария не обнаружено. [22]
Гадолиния оксид ( окись гадолиния), хлорид ( хлористый гадолиний); гольмия оксид ( окись гольмия); диевропия диоксидсульфид ( оксисульфид европия); дииттрия диоксидсульфид ( оксисульфид иттрия); диспрозия оксид ( окись диспрозия), сульфид ( сернистый диспрозий), хлорид ( хлористый диспрозий); иттербия оксид ( окись иттербия); иттрия оксид ( окись иттрия), сульфид ( сернистый иттрий), фторид ( фтористый иттрий), хлорид ( хлористый иттрий); лантана гексаборид, нитрат гексагидрат ( шестиводный азотнокислый лантан), оксид ( окись лантана), сульфат ( сернокислый лантан), хлорид ( хлористый лантан); лютеция оксид ( окись лютеция), хлорид ( хлористый лютеций); неодима оксид ( окись неодима), хлорид ( хлористый неодим); празеодима ( III) оксид ( окись празеодима), хлорид ( хлористый празеодим); самария ( III) оксид ( окись самария); скандия нитрат ( азотнокислый скандий), оксид ( окись скандия); тулия оксид ( окись тулия); церия гексаборид, церия ( III) оксид ( окись церия), сульфид ( сернистый церий), фторид ( фтористый церий, флюоцерит - мин. IV) оксид ( двуокись церия, цериа-нит - мин. [23]
Окись самария сульфидируют по спо-еобу, описанному для окиси празеодима. Загрузка окиси самария составляет 50 г; оптимальными условиями являются: температура 1300, время сульфидирования 4 часа. [24]
Их окраска довольно разнообразна; окислы лантана, трехвалентного церия, гадолиния, иттербия и лютеция бесцветны; Ег203, ТЬ203 и в меньшей степени Еи203 имеют розоватый оттенок. Желтоватая окраска характерна для окиси самария, диспрозия и гольмия, для Nd203 - голубоватая, для Рг203 - зеленая. [25]
Самарий, стандартный раствор, содержащий 1 мг Sm в 1 мл. Растворяют 0 1159 г окиси самария в 5 - 10 мл разбавленной ( 1: 1) азотной кислоты и выпаривают под инфракрасной лампой почти досуха. В 1 мл такого раствора содержится 1 мг самария. [26]
Первый метод, оказывается, дает лучшие выхода альдегидов как из метилового, так и из этилового спиртов. Во втором - методе окись самария промотирует активность катализатора настолько, что происходит окисление далее стадии альдегида, и альдегид получается со значительно более низким выходом. Поэтому второй метод, как это установлено, не имеет преимуществ в случае метилового и этилового спиртов; зато он может оказаться пригодным в случае веществ, окисляющихся несколько труднее. Было высказано предположение, что присутствие окисей редких земель сводит к минимуму отравление катализаторов и таким образом сильно повышает продолжительность их жизни. [27]
Метод восстановления окиси самария парами кальция называется кальциетермическим. В реакционную камеру здесь помещают порошок окиси самария, порошок кобальта и кальций. При температуре 1000 - 1200 С происходит указанная реакция и образуется порошок соединения SmCo5 и окисел кальция. [28]
Начало активированной адсорбции кислоты совпадает с началом реакции каталитической кетонизации этой кислоты при проведении ее в импульсном хроматографическом режиме на окиси самария. Это позволило автору [74] экспериментально обосновать схему протекания процесса через образование поверхностного солеобразного комплекса соответствующей кислоты с окисью самария. [29]
Взаимодействие между исходными компонентами начинается в порошкообразных смесях через точечные контакты. В дальнейшем более подвижный компонент ( двуокись титана) благодаря поверхностной диффузии образует слой данного компонента на поверхности второго компонента ( окиси самария), что сильно увеличивает фронт реакции, а следовательно, и скорость. [30]
Страницы: 1 2 3