Окись - фтор
Cтраница 1
Окись фтора 02F2 не взаимодействует с JF5 при 90 - 195 К [82], имеет место лишь слабое разложение 02F2 на кислород и фтор; при более жестких условиях, видимо, будет происходить образование гептафторида иода. [1]
 |
Свойства описи фто ia. [2] |
В окиси фтора содержатся примеси кисло ]; эда и фтористого водорода, которые удаляются очисткой. [3]
Взаимодействует ли окись фтора F2O с водой и щелочами. [4]
Теплота образования окиси фтора 130 ккал / кг; аналогично озону она обладает сильно выраженными окислительными свойствами. Окись фтора высокотоксичное вещество; при 300 она распадается на фтор и кислород. При обычной температуре окись фтора при смешении с водородом, метаном и другими веществами не дает воспламенения, как это наблюдается при смешении указанных веществ с фтором. [5]
С кислородом фтор образует окись фтора F20 - бесцветный газ с характерным запахом; ядовит. В этом соединении атомы кислорода и фтора находятся в ковалентной связи. [6]
Если не предусмотреть поглощение окиси фтора, она может сконденсироваться в сборнике, охлаждаемом жидким воздухом, и взорваться при нагревании. Электролизер необходимо снабжать указателем уровня электролита. В противном случае при понижении уровня электролита в освободившемся пространстве может скопиться достаточно большое количество окиси фтора, которая взрывоопасна как сама по себе, так и в смеси с водородом. Гофман и Симмонс22 рекомендуют предупреждать возможные по этой причине взрывы путем пропускания тока азота через электролизер при фторировании кислородсодержащих веществ. [7]
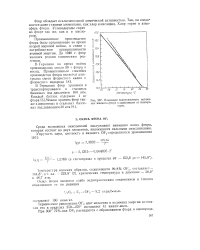 |
Изменение поверхностного натяжения жидкого фтора в зависимости от температуры. [8] |
Среди возможных окислителей заслуживает внимания окись фтора, которая состоит из двух элементов, являющихся сильными окислителями. [9]
Благодаря высокой энергии активации разложения окись фтора может быть смешана с водородом, метаном и другими веществами без наступления воспламенения, как это наблюдается при смешении указанных веществ со фтором. [10]
Концентрированные растворы щелочи быстро разрушают окись фтора. Окись фтора характеризуется сильно выраженными окислительными свойствами, аналогичными озону. [11]
В патентной литературе описано получение окиси фтора OF2, или двуфтористого кислорода, путем электролиза плавиковой кислоты, содержащей добавки фторида щелочного металла и небольшое ( 0 1 - 2 мол. Анод изготовляется из никеля, катод - из стали или никеля. Источником кислорода в этом случае является вода, находящаяся в электролите. Кроме двуфтористого кислорода и водорода среди газообразных продуктов электролиза обнаружены кислород и озон. [12]
Несколько меньшее значение было опубликовано для окиси фтора ( Берш, 1935 г.), но оно не является вполне надежным. Благодаря малой рассеивающей способности атома водорода пары воды не являются сами по себе удобным объектом для изучения по методу диффракции электронов. После пересмотра приводимых результатов в первый момент может показаться, что естественный угол валентности кислорода приближается больше к значению, соответствующему тетраэдрической структуре, чем к величине 90, предлагаемой П аулингом. Этот вывод не может быть, однако, полностью оправдан. [13]
При охлаждении до - 145 С окись фтора сгущается в желтую жидкость ( плотность 1 5 г / см3), затвердевающую при - 224 С. Критическая температура F2O равна - 58 С, критическое давление 49 атм. Жидкая окись фтора способна растворять большие количества воздуха. Напротив, в щелочной среде ( или под действием восстановителей) разложение F2O идет довольно быстро. Окись фтора является сильным окислителем и очень ядовита. [14]
При охлаждении до - 145 С окись фтора сгущается в желтую жидкость ( плотность 1 5 г / см3), затвердевающую при - 224 С. Критическая температура F2O равна - 58 С, критическое давление 49 атм. Жидкая окись фтора смешивается в любых соотношениях с жидкими О2, F2, O3 и способна растворять большие количества воздуха. Напротив, в щелочной среде ( или под действием восстановителей) разложение F2O идет довольно быстро. Окись фтора является сильным окислителем и очень ядовита. [15]
Страницы: 1 2 3 4