Образующаяся окись - азот
Cтраница 2
Согласно реакции поглощения, количество образующейся окиси азота в 3 раза меньше количества поглощенной двуокиси азота. [16]
Согласно реакции поглощения, количество образующейся окиси азота в т-ри раза меньше количества поглощенной двуокиси азота. [17]
Согласно реакции поглощения, количество образующейся окиси азота в три раза меньше количества поглощенной двуокиси. [18]
Согласно реакции ( 138), количество образующейся окиси азота в три раза меньше количества поглощенной двуокиси азота. [19]
Согласно реакции ( 28), количество образующейся окиси азота в 3 раза меньше количества поглощенной двуокиси азота. [20]
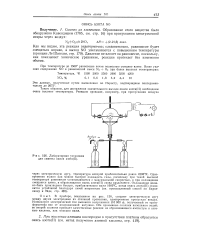 |
Лабораторная установка для синтеза окиси азота ( П. [21] |
Одновременно нужно как можно быстрее охлаждать газы, поскольку при такой высокой температуре равновесие устанавливается с максимальной скоростью, а при охлаждении смещается влево, и образующаяся окись азота ( П) снова разлагается. Охлаждение должно быть произведено быстро, приблизительно ниже 1000 С, когда окись азота ( П) становится устойчивой благодаря своей инертности ( см. промышленный способ по Бирке-ланду и Эйде, стр. [22]
Окислы азота получаются при наличии атомарного кислорода в тех зонах камеры сгорания, в которых резко повышается температура в результате химической реакции окисления углеводородов топлпва. Количество образующейся окиси азота зависит от содержания азота и кислорода в продуктах сгорания. [23]
Однако при температуре выше 2000 С происходит заметная диссоциация окиси азота, что снижает и без того малый выход. Поэтому образующуюся окись азота быстро охлаждают, а затем, после окисления до двуокиси азота, поглощают водой с получением азотной кислоты. Метод слишком дорог: расход энергии составляет 60000 кет-ч на I т связанного азота, и поэтому в настоящее время в промышленности не применяется. [24]
Уровень ртути в бюретке и трубке устанавливают на одной высоте. Рассчитывают навеску нитрата исходя из того, чтобы образующаяся окись азота заняла V4 - 3 / 4 объема бюретки. [25]
Обратимыми называются реакции, при которых получающиеся вещества способны взаимодействовать друг с другом, образуя исходные вещества. Например, при одних и тех же условиях может одновременно происходить соединение азота с кислородом и разложение образующейся окиси азота на азот и кислород. [26]
Роль этого процесса заключается только в подогреве смеси азота с избыточным кислородом. Количество образующейся окиси азота однозначно определяется температурой горения, содержанием кислорода и азота в продуктах сгорания и режимами нагревания и охлаждения азото-кислородной смеси. Окись азота сохраняется в продуктах сгорания только вследствие закалки, так как при достаточно медленном охлаждении образовавшаяся при высоких температурах эндотермическая окись азота снова разложилась бы на элементы. При нормальном режиме топочных процессов обычно образуется немного окиси азота, однако этого количества вполне достаточно для опасного накопления окислов в процессах глубокого охлаждения. При достаточно высокой температуре горения некоторое количество окиси азота образуется и в смесях с избытком горючего в результате равновесной диссоциации продуктов сгорания. [27]
Для получения высокого выхода основным требованием является применение достаточно пористой окиси бария; с производственной точки зрения это более значительная проблема, чем превращение окиси в перекись, так как разложение бариевой соли при высокой температуре может сопровождаться спеканием и образованием твердой и нереакционноспособной окиси. В течение XIX столетия окись бария получали почти исключительно из азотнокислого бария, который довольно быстро разлагается при 600 - 800, однако процесс был весьма затруднительным и дорогостоящим, поскольку в результате его всегда образуется расплав нитрата, нитрита и окиси. Это приводило к необходимости вести процесс небольшими периодическими операциями в закрытых, тиглях с внешним обогревом, причем возникали трудности, вызванные необходимостью отвода и регенерации образующейся окиси азота. Поэтому уже в самом начале XX столетия описанный процесс был вытеснен другим-получением окиси бария из углекислого бария. [28]
 |
Прибор для окисления аммиака.| Схема аппарата для заводского окисления аммиака. [29] |
На рис. 67 показана схема заводского окисления аммиака до окиси азота, перевода окиси азота в двуокись с последующим получением азотной кислоты. На этих установках получают азотную кислоту. Смесь аммиака и воздуха поступает после подогрева в конвертор, в котором помещены в несколько ярусов сетки, сделанные из сплава платины с родием, играющие роль катализатора. Образующаяся окись азота поступает в окислительную башню, где идет превращение окиси азота в двуокись. Образовавшаяся двуокись поступает в поглотительную башню, где и образуется азотная кислота. Вода подается сверху в виде мелкого дождя, а двуокись идет снизу навстречу этому дождю. [30]
Страницы: 1 2 3