Оксалат-ион
Cтраница 1
 |
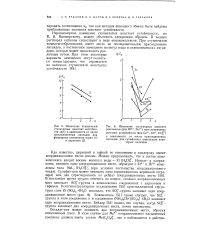
Комплекс ЭДТА. [1] |
Оксалат-ион имеет десять неподеленных электронных пар, однако их ориентация относительно плоского иона С С - СО2 препятствует одновременному использованию одним атомом железа более двух электронных пар. Углы между связями О-С - С-О допускают образование двух донорных связей с каждым оксалат-ионом. [2]
 |
Классификация анионов, основанная на их окислительно-восстановительных свойствах. [3] |
Оксалат-ион С2О4 заметно обесцвечивает раствор перманганата калия только при нагревании. [4]
Оксалат-ион может занимать два координационных места, образуя пятичленный цикл. [6]
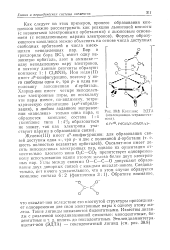 |
Комплекс ЭДТА ( этиленднамин-тетрааиетат-иока. [7] |
Оксалат-ион имеет десять неподеленпых электронных пар, однако их ориентация относительно плоского нона 02С - СО2 препятствует одновременному использованию одним атомом железа более двух электронных пар. Углы между связями О-С - С-О допускают образование двух донорных связей с каждым оксалат-ионом. [8]
Комплексный оксалат-ион [ Ве ( С2О4) 2 ] 2 - характеризуется малой прочностью. Это подтверждается данными по электропроводности двойных оксалатов. [9]
Присутствие оксалат-ионов в испытуемом растворе очень затрудняет ход анализа смеси катионов I, II и III аналитических групп, поэтому прежде всего их нужно удалить из раствора. [10]
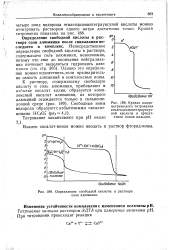 |
Кривая ациди-метрического титрования этилендиаминтетрауксус-ной кислоты в присутствии ионов кальция.| Определение свободной кислоты в растворе соли алюминия. [11] |
Взамен оксалат-ионов можно вводить в раствор фторид-ионы. [12]
Концентрацию оксалат-ионов вычисляют обычным путем с учетом констант диссоциации щавелевой кислоты и рН раствора. Подставляя полученные значения концентраций компонентов [ А13 ], [ AIQO J, [ C2Of - ] в уравнение ( 6), рассчитывают константу нестойкости оксалатного комплекса алюминия. [13]
Присутствие оксалат-ионов в исследуемом растворе, так же как и присутствие фосфат-ионов, осложняет ход анализа катионов второй аналитической группы, так как оксалаты могут осаждаться вместе с карбонатами. Осадок второй группы необходимо растворять в уксусной кислоте, но в этой кислоте оксалаты бария и стронция слабо растворимы, а оксалат кальция не растворим даже в кипящей уксусной кислоте. [14]
Для оксалат-иона характерна способность к образованию комплексных ионов с элементами IV и VI групп периодической системы: олова, молибдена, вольфрама, и катионами металлов семейства железа. [15]
Страницы: 1 2 3 4