Оксид - железо
Cтраница 2
Оксид железа ( II, III) Fe3O4 встречается в природе в виде минерала магнетита. Хороший проводник тока, а потому используется для изготовления электродов. [16]
 |
Схема образования окалины при нагревании железа на воздухе. [17] |
Оксид железа ( III) образуется до температуры 100 С a Fe3O4 - при 400 - 575 С. Эти оксиды имеют кристаллические решетки сложного строения, и процессы диффузии кислорода в них затруднены, тогда как FeO образуется при температуре выше 575 С и имеет простую решетку гранецентрированного куба, содержащую дефекты, в результате чего FeO не обладает свойствами защитной пленки. [18]
Оксиды железа и железо образуют между собой сложную диаграмму плавкости, рассмотрение которой выходит за рамки данного курса. [19]
Оксид железа ( II) - черный порошок, проявляет основные свойства, реагирует с кислотами с образованием солей. [20]
Оксид железа ( III) - порошок красно-бурого цвета под названием железный сурик или мумия применяется как коричневая краска. [21]
Оксид железа ( II) FeO - черный легко окисляющийся порошок. [22]
Оксиды железа, никеля, хрома и других переходных металлов. По данным [79], полоса поглощения с максимумом 3410 см 1 относится к валентным колебаниям ОН-групп оксида железа, связанных между собой Н - связью. В [78] установлено, что концентрация ОН-групп на поверхности оксида никеля ( NiO) резко снижается при термообработке его выше 523 К. Данные о химии поверхности оксидов кобальта, меди немногочисленны и в ряде случаев весьма противоречивы. [23]
Оксид железа ( III) образуется до температуры 100 С, a Fe3O4 - при 400 - 575 С. [24]
Оксиды железа, потерявшие способность далее окисляться водой, для продолжения реакции необходимо восстанавливать до металлического железа. Восстановление проводят так называемым газом-восстановителем ( водяной газ), представляющим собой смесь, содержащую 50 % водорода и 50 % окиси углерода. При воздействии водяного газа оксиды железа восстанавливаются до металлического железа, тогда как компоненты водяного газа окисляются до воды и двуокиси углерода. [25]
Оксиды железа растворимы в минеральных неокислительных кислотах, особенно хорошо - FeO, который стравливается в первую очередь и способствует отслаиванию вышележащих слоев. [26]
Оксид железа Ре2Оз, полученный высушиванием гидр-оксида железа ( III) при 110 - 120 С, начинает восстанавливаться водородом при 270 С, но реакция при этой температуре протекает довольно медленно и продукт получается пирофорным. В этих условиях восстановление заканчивается через 15 - 20 мин и железо образуется в виде тончайшего пррошка, но пирофорными свойствами уже не обладает. [27]
Оксид железа ( II) FeO получают восстановлением оксида железа ( III) или окислением металлического железа. Процесс восстановления проводят при 700 - 800 С. [28]
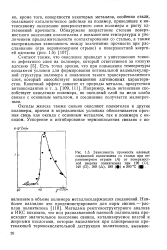 |
Зависимость прочности клеевых соединений полиэтилена со сталью при неравномерном отрыве ( А от поверхностной энергии полиэтилена при 120 ( О, 140 ( П, 160. ( А, 180 ( и 200 С (. [29] |
Оксиды железа также сильно окисляют полиэтилен и другие полимеры, причем в определенных условиях обеспечивается прочная связь как оксида с основным металлом, так и полимера с оксидом. [30]
Страницы: 1 2 3 4