Оксид - магний
Cтраница 1
Оксид магния малорастворим в воде; однако ему соответствует основание - гидроксид магния Mg ( OH) 2, который можно получить из оксида магния косвенным путем. [1]
Оксид магния очень медленно гасится водой. [2]
Оксид магния и фторид натрия имеют одинаковые кристаллические структуры. [3]
Оксид магния на химические процессы, приводящие к сшиванию ХСПЭ ( под действием тиурамов, не влияет. Однако, судя по ИК-спектрам, количество гидрохлоридов в продуктах прогрева при введении оксида магния уменьшается вследствие частичного связывания оксидом магния отщепляющегося хлористого водорода. [4]
Оксид магния является основой широкого ассортиме. [5]
Оксид магния, полученный при прокаливании 50 4 г карбоната магния, растворен в строго необходимом количестве 25 % - ной серной кислоты. [6]
Оксид магния относительно легок ( 3 5 т / м3), но имеет высокую теплоемкость [ С 1 3 кДж / ( кг - К) ], высокие температуру ( Тт - 2800 С) и теплоту [ L 1 8 МДж / ( кг - К) ] плавления. Оксиды магния и урана образуют жидкую эвтектику ( молярное содержание 50 %) при Т 2200 - г 2300 С. [7]
Оксиды магния, кремния и церия имеют стабилизирующее действие и могут поддерживать поверхности на таком высоком уровне, как 30 м2 / г при 1200 С. [8]
Оксид магния имеет высокую точку плавления ( 2500 С), поэтому его часто используют при изготовлении огнеупорных футеровок. Он также входит в состав корма для животных, удобрений, изоляционного материала, обшивочного листа, нефтяных присадок и электрических нагревательных стержней. Оксид магния применяют в целлюлозной и бумажной промышленности. Помимо всего прочего, он служит катализатором в каучуковой промышленности и отражателем в оптических приборах. [9]
Оксид магния адсорбирует кремнезем из воды. [10]
Оксиды магния и кальция, занимая вакансии в структуре оксида алюминия, сохраняют тетраэдрические координации алюминия с кислородом и препятствуют фазовым переходам оксида алюминия. [11]
Оксид магния адсорбирует кремнезем из воды. [12]
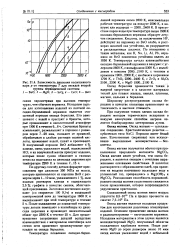 |
Зависимость давления насыщенного пара р от температуры Т для оксидов второй. [13] |
Оксид магния получается обычно при прокаливании природного магнезита MgCOs. Оксид магния менее устойчив, чем оксид бериллия, и является оксидом с отчетливо выраженными основными свойствами. В кислотах растворяется с образованием солей, при хранении на воздухе постепенно поглощает воду и углекислый газ, превращаясь в Mg ( OH) 2 и MgCOs. Реакционная способность порошкообразного оксида магния существенно снижается после прокаливания, которое сопровождается укрупнением кристаллов. [14]
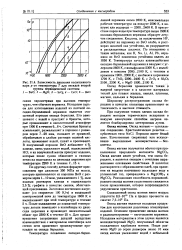 |
Зависимость давления насыщенного пара р от температуры Т для оксидов второй. [15] |
Страницы: 1 2 3 4