Оксид - пиридин
Cтраница 1
Оксиды пиридина и его гомологов, производных хинолина нитруются до 4-нитропроизводных. При р-ции с РОС13, РС15, 5ОС12 образуются 1 - и 4-хлорпроизводные, с ангидридами и галогенангидридами к-т - 2-ацилоксипроизвод-ные, с металлоорг. [1]
Оксиды пиридинов обладают фунгицидными и бактерицидными свойствами. [2]
Оксиды пиридина обладают черезвычайно интересной реакционной способностью [229], существенно отличающейся от реакционной способности как самих пиридинов, так и четвертичных пиридиниевых солей. [3]
Оксиды пиридинов обладают фунгицидными и бактерицидными свойствами. [4]
Оксид пиридина может быть получен при действии на пиридин перуксусной кислоты, которая образуется in situ из HzOz и уксусной кислоты. Взаимодействие пиридина с гидроксиламин - О-сульфоновой кислотой приводит к М - ами-нопиридиниевым солям. Химия N-оксидов и N-имидов подробно обсуждается в разд. [5]
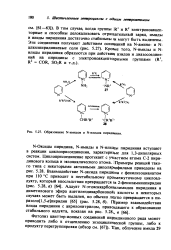 |
Образование N-имидов и N-илидов пиридщния. [6] |
Оксиды пиридина, N-имиды и N-илидды пиридиния вступают в реакции циклоприсоединения, характерные для 1 3-диполярных систем. Циклоприсоединение протекает с участием атома С-2 пиридинового кольца и экзоциклического атома. [7]
Оксид пиридина, который легче всего получить обработкой пиридина перкислотой ( перукеусной или пербензойной), является гораздо более слабым основанием, чем пиридин. Направляющее влияние N-оксида таково, что в большинстве случаев наблюдается замещение в положение 4, например он легко нитруется в это положение. Исключение составляет введение гидроксила или диметиламиногруппы в положение 2, Если положение 4 блокировано, осуществить нитрование обычно не удается. Прямое галогенирование и сульфирование идут с трудом, а реакции Фриделя - Крафтса, как и с самим пиридином, невозможны. [8]
Оксиды пиридинов нитруются гораздо легче исходных оснований. [9]
Метод хлорирования jV - оксидов пиридинов не получил большого развития; имеется всего несколько сообщений. [10]
Среди реакций А - оксидов пиридинов с нуклеофнлами лишь немного ( если они есть вообще) примеров прямого замещения водорода. Как правило, присоединение нуклеофила ( преимущественно в положение 2) идет с протонированнем аниона Л - окснда, после чего отщепляется вода ср. [11]
Установлено, что в отличие от пиридина, который подвергается электрофильному замещению лишь с трудом и в же / тга-положении, оксид пиридина взаимодействует с электрофильными реагентами легко, и реакция направляется в орто - и пара-положения. Это говорит о вкладе канонических форм II и III в мезомерный гибрид молекулы. [12]
Прямое нитрование пиридинов с препаративной целью успешно проходит только в случае пиридинов с пространственно затрудненным гетероатомом или активированных донорными заместителями в кольце. Самый простой путь к 4-нитропиридинам представляет нитрование / / - оксидов пиридинов с последующим восстановлением. Нитропиридины получают также окислением аминопиридинов сильными пероксикислотами [113, 2196, 2216, 394], например кислотой Каро или трифторперуксусной кислотой; в последнем случае образуются Af-оксиды нитропиридинов. Этот обычный путь синтеза 2-нитропиридинов часто применяют и для получения 3-нитроизомеров. [13]
Обратимо димеризуется на свету. Легко восстанавливается в акридан ( 9 10-дигидроакридин) амальгамой Ыа, 2п в НС1 и на никеле Ренея. Под действием КМпО4 в щелочной среде и при озонолизе в спирте окисляется в 2 3-хинолиндикарбоновую к-ту, надбензойной к-той-в Ы - оксид, способный, подобно М - оксиду пиридина, к р-циям замещения. С образуется 9-тиоакридон, при взаимод. В р-ции с Вг2 в СС14 образуется ТЧ-бромакридинийбромид, в СН3СООН - 2-бром - и 2 7-дибромакридин. Вступает в р-цию Чичибабина с НаМН2, образуя 9-аминоакридин. [14]
Страницы: 1