Оксид - стронций
Cтраница 2
Оксид стронция применяют в сахароварении для выделения сахара из мелассы, так как он с сахаром дает сахарат состава С12Н22О11 2SrO, мало растворимый в воде. Помимо этого, SrO служит исходным сырьем для получения других соединений стронция. [16]
Оксиды стронция и бария SrO и ВаО сходны с оксидом кальция. Оба металла образуют также пероксиды. Пероксид бария ВаО2 получается при нагревании оксида бария па воздухе примерно до 500 С. При высокой температуре она снова разлагается на оксид и кислород. Пероксид бария, как и пероксид натрия, используют для беления различных материалов. [17]
Оксид стронция ( SrO) дает широкую размытую полосу в оранжево-красной части спектра с максимумом излучения около 0 60 мкм. Идентичный спектр дает и нитрат стронция. [18]
Оксиды стронция и бария SrO и ВаО сходны с оксидом кальция. Оба металла образуют также перекиси. Перекись бария ВаСЬ получается при нагревании оксида бария на воздухе примерно до 500 С. При высокой температуре на снова разлагается на оксид и кислород. Перекись бария, как и перекись натрия, используют для беления различных материалов. [19]
Оксид стронция SrO и карбонат стронция ЗгСОз вводят в состав керамических материалов для производства ферритов, используемых в цветных телевизорах. Для задерживания рентгеновского излучения кинескопов применяют стекла, содержащие SrO. Эти вещества придают глазурям и эмалям дополнительную твердость и термостойкость. Хлорид стронция SrCb, как и CaClj, используют в холодильном деле, косметике и медицине. [20]
АЬО: ь оксид стронция - основной оксид, а оксид алюминия амфотерен. Поэтому в реакцию с кислотой вступают оба, а со щелочью реагирует только оксид алюминия. Уравнения реакций составьте самостоятельно. [21]
Получают при действии оксида стронция или сульфида стронция на азотную кислоту в виде безводной соли при повышенных температурах или в виде гидратированной соли ( с четырьмя молекулами воды) при пониженных температурах. Бесцветный кристаллический порошок, расплывающийся на воздухе, растворимый в воде, разлагающийся при нагревании. Используется в пиротехнике для получения красных огней; а также при изготовлении спичек. [22]
Получается действием кислорода на оксид стронция. Белый порошок, разлагается горячей водой. [23]
Пламя, получающееся при излучении оксида стронция, имеет лишь розовую окраску, так как вследствие его малой летучести ( выше 2500 С) создать в пламени значительную концентрацию паров оксида стронция трудно. [24]
Определение основано на растворении гидроксида и оксида стронция в хлороводородной кислоте с образованием хлорида стронция и последующем его анализе методом пламенной фотометрии по синей полосе спектра пламени стронция. [25]
Предложено 17 ] получать хлорид стронция взаимодействием оксида стронция с водным раствором хлористого аммония при кипячении. [26]
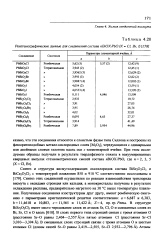 |
Рентгенографические данные для соединений состава пВЮХ - РЬО ( X С /, Вг, I. [27] |
Синтез этих соединений осуществлен по реакции взаимодействия трихлорида висмута с оксидами стронция или кальция, а монокристаллы получены в результате охлаждения расплава, предварительно нагретого на 30 С выше температуры плавления. Полученные соединения изоструктурны друг другу, имеют ромбическую синго-нию с параметрами кристаллической решетки соответственно: a 6 687 и 6 383, 611 4618 и 10 803, с 11 565 и 11 422 A; Z4, пр. [28]
Хорошие магнитные свойства имеют ферриты стронция с малыми добавками оксида кальция вместо оксида стронция, анизотропные образцы при этом имели ( ВЯ) макс 4 - 10 - 2 Т - А / м, что является пока лучшим результатом для всех магнитотвердых ферритов. [29]
Запасы асбеста, алмазов, оксида бора, пентоксида ванадия, оксида лития, оксида стронция, минеральных красок, мышьяка, меди, никеля, рассеянных элементов, редких земель, свинца, цинка, серебра, оксида циркония учитываются только до 0 1, остальных полезных ископаемых - с округлением до целых единиц. [30]
Страницы: 1 2 3