Оксид - цинк
Cтраница 1
Оксиды цинка, кадмия и ртути различаются цветом: ZnO - белый, CdO - бурый, HgO - желтый или красный и [ Hg2lO - черный. Оксиды ртути при нагревании неустойчивы и распадаются на ртуть и кислород. [1]
Оксид цинка по химической природе амфотерен, все остальные имеют основной характер. С водой они не реагируют, растворяются лишь в кислотах, а оксид цинка также в растворах щелочей. [2]
Оксиды цинка и ртути ( II) применяют в небольших количествах в медицине. [3]
Оксид цинка получается в виде суспензии, которую подвергают сгущению. Твердую фазу отделяют, сушат и прокаливают, а сухой продукт размалывают и упаковывают. Полученный таким образом оксид цинка представляет собой порошок от белого до светло-желтого цвета. Его упаковывают в бумажные битуминирован-ные мешки. В товарном высушенном продукте должно быть не менее 96 % соединений цинка ( в пересчете на ZnO), не более 0 8 % водорастворимых веществ, не более 0 1 % влаги, не более 0 25 % веществ, нерастворимых в соляной кислоте. [4]
Оксид цинка обеспечивает эффективную защиту от солнечного излучения. [5]
 |
Диаграмма состояния системы кадмий - медь. [6] |
Оксид цинка - основа цинковых белил, а сульфид применяется для фиксации альфа -, бета - и грамма-радиации. Халькогениды и пниктогениды цинка и кадмия находят широкое применение в полупроводниковой технике - начиная от термоэлементов и кончая полупроводниковыми лазерами. [7]
Оксид цинка ( II) ZnO - рыхлый белый порошок, используемый для изготовления краски - цинковых белил. [8]
Оксид цинка и его аналогов ( ЭО) могут быть получены путем непосредственного соединения элементов с кислородом при нагревании. В противоположность белому ZnO аналогичные оксиды Cd и Hg имеют коричневый ( CdO) или ярко-красный ( HgO) цвет. При очень тонком измельчении оксида ртути цвет ее становится желтым. В воде оксиды Zn, Cd и Hg почти нерастворимы, но в кислотах легко растворяются, образуя соответствующие соли. [9]
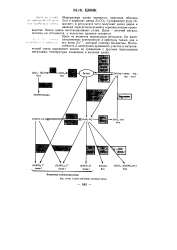 |
Схема некоторых реакций цинка. [10] |
Оксид цинка восстанавливают углем. Цинк - летучий металл, поэтому он отгоняется, а нелетучие примеси остаются. [11]
Оксид цинка применяют для изготовления термосопротивлений и в других целях. [12]
Оксид цинка - активатор серной вулканизации непредельных каучуков, применяется в виде тонкодисперсного порошка и поэтому на подготовительном производстве происходит интенсивное выделение его пыли. По степени воздействия на организм человека оксид цинка относится к Ш классу опасности. Высокодисперсная пыль оксида цинка вызывает заболевания верхних дыхательных путей, желудочного тракта и почек. [13]
Оксид цинка кристаллизуется в гексагональной синго-нии, элементарная ячейка имеет форму тетраэдра [272] с параметрами а 0 32495 нм, с 0 52069 нм. Структура оксида цинка характеризуется отсутствием центра симметрии, вследствие чего кристаллы имеют полярную ось. В процессе вулканизации оксид цинка сохраняет кристаллическую структуру и вследствие этого особенности кристаллической структуры и наличие единичной полярной оси играют важную роль при физической адсорбции ускорителей и серы. [14]
Оксид цинка, меркаптид цинка, диалкилдитиокарбамать цинка, сера и ДТДМ проявляют электрофильные свойства ш отношению к ускорителям, приведенным выше. [15]
Страницы: 1 2 3 4