Основной оксид
Cтраница 3
Некоторые основные оксиды при взаимодействии с водой образуют основания. [31]
Некоторые основные оксиды: окись натрия Na2O, окись калия КдО, окись кальция СаО, окись магния MgO, окись бария ВаО - взаимодействуют с водой. В результате химической реакции получаются растворимые в воде гидроксиды - щелочи. [32]
Все основные оксиды являются оксидами металлов. Кислотные оксиды - это оксиды, гидраты которых являются кислотами. [33]
Все основные оксиды являются оксидами металлов. [34]
Все основные оксиды взаимодействуют с кислотами, образуя соль и воду. [35]
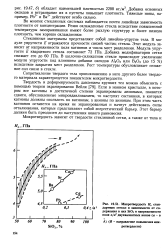 |
Микротвердость Яц стандартных стекол в зависимости от содержания в них SiO2 и напряженности поля г / о2 двухвалентных ионов ( а - в. [36] |
Добавка основных оксидов и встраивание их в пустоты повышает плотность. Тяжелые ионы, например, РЬ2 и Ва2 действуют особо сильно. [37]
Для основных оксидов характерны ионные или сильно полярные связи в молекуле, что обусловливает прочность их кристаллических решеток и способность быть донорами оксид-ионов. Эта способность выражается прежде всего в том, что оксиды активных металлов при взаимодействии с водой образуют гидроксиды, являющиеся типичными основаниями. Оксиды активных металлов способны также нейтрализовать кислоты, являющиеся донорами протонов, посредством связывания последних оксид-ионами в воду. [38]
Для основных оксидов характерны ионные или сильно полярные связи между атомами, что обусловливает прочность их кристаллических решеток и способность к поляризации атомов кислорода. Эта способность выражается прежде всего в том, что оксиды активных металлов при взаимодействии с водой образуют гидроксиды, являющиеся типичными основаниями. Оксиды активных металлов способны также нейтрализовать кислоты, являющиеся донорами протонов, посредством связывания последних в воду. [39]
Большинство основных оксидов с водой не взаимодействуют, тю им также соответствуют основания ( гидроксиды), которые можно получить косвенным путем. [40]
Для основных оксидов характерны ионные или сильно полярные связи в молекуле, что обусловливает прочность их кристаллических решеток и способность быть донорами оксид-ионов. Эта способность выражается прежде всего в том, что оксиды активных металлов при взаимодействии с водой образуют гидроксиды, являющиеся типичными основаниями. Оксиды активных металлов способны также нейтрализовать кислоты, являющиеся донорами протонов, посредством связывания последних оксид-ионами в воду. [41]
Добавление основных оксидов ( типа оксидов кальция и магния) ускоряет процесс отверждения. Действие серосодержащих добавок ( пирит, сульфид цинка, литопон) сводится к окислению серы до оксидов, в результате чего предотвращается образование сильноклейких слоев из оксидов металлов, замедляется окислительная деструкция фенольной смолы и в конечном счете увеличивается срок службы абразивного круга. Специфическое влияние криолита обусловлено, вероятно, его относительно низкой температурой плавления: криолит плавится при высоких температурах в поверхностном слое, и образующиеся в материале полости способствуют повышению эффективности процесса шлифования. В то же самое время расплав может служить своеобразной смазкой, облегчающей шлифование. Для повышения прочности абразивных кругов применяют различные армирующие материалы - стеклоткань, текстильные ткани, нетканые материалы или крафтбумагу. [42]
Для основных оксидов характерны ионные или сильно полярные связи в молекуле, что обусловливает прочность их кристаллических решеток и способность быть донорами оксид-ионов. Эта способность выражается прежде всего в том, что оксиды наиболее активных металлов при взаимодействии с водой образуют гидроксиды, являющиеся типичными основаниями. Оксиды активных металлов способны также нейтрализовать кислоты, являющиеся донорами протонов, посредством связывания последних оксид-ионами в воду. [43]
Для более основных оксидов наблюдается увеличение положительного заряда на поверхности с ростом кислотности среды. Гидр-оксильные группы уходят с поверхности и в растворе нейтрализуются ионами водорода. Например, золь оксида железа более устойчив в кислой среде, в которой частицы имеют положительный заряд. Менее основные оксиды, такие, как кремнезем, приобретают в кислой среде положительный заряд ( ниже изоэлектрической точки) в результате адсорбции ионов водорода на гидроксильных группах поверхности. [44]
Взаимодействие основного оксида FeO с амфотерным Fe2O3 приводит к образованию шпинели ( см. стр. [45]
Страницы: 1 2 3 4