Стеклообразующий оксид
Cтраница 2
Стеклообразующие оксиды ( например, SiO2, A12O3, В2О3, Р2О3) образуют пространственную сетку из однородных звеньев-полиэдров, а модифицирующие оксиды, располагаясь внутри ячеек сетки, ослабляют или разрывают связи в стеклообразующих оксидах и снижают прочность, термо - и химическую стойкость стекла, но позволяют регулировать температуру его размягчения и другие свойства. [16]
S, Se, As, С, Р), оксиды ( SiOz, ВаОз, РгОз, GeO2, AszO3 и др.), а также бинарные, тройные и многокомпонентные составы на основе стеклообразующих оксидов, галогенидов ( BeF2), халькоге-нядов ( AsSa, Sb2Se3), карбонаты, сульфаты, селениты и др.; нек-рые сплавы, напр. [17]
В состав неорганического стекла входят стеклообразующие оксиды, модифицирующие оксиды ( щелочные и щелочноземельные) вида Ме2О и МеО, изменяющие физико-химические свойства стекол; технологические добавки ( оксиды алюминия, железа, свинца, титана, бериллия и др.), замещающие стеклообразующие оксиды и придающие стеклу необходимые потребительские свойства. [18]
Для оксидов заряд аниона Z2 и заряд электрона е постоянны, и мерой напряженности поля является отношение Z / a2, где Z - заряд катиона; а - длина связи. Для типичных стеклообразующих оксидов среднее значение этой величины составляет 0 1 - 0 2 нм, для модификаторов 0 01 - 0 04 нм. [19]
Полупроводящую глазурь приготовляют различными способами. По одному способу электропроводящие и стеклообразующие оксиды измельчают и смешивают помолом мокрым способом. [20]
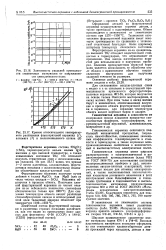
К сожалению, данные о полупроводниковых свойствах перечисленных стеклообразующих оксидов отсутствуют. [21]
Вероятность образования при этом центров кристаллизации невелика и получаемый материал представляет собой кристаллы, распределенные среди массы, застывшей в аморфном состоянии. Для ряда расплавов, особенно содержащих так называемые стеклообразующие оксиды, например SiO2, B2O3, Р2О5, возможно создание условий, при которых центры кристаллизации вообще не образуются. [22]
 |
Состав важнейших промышленных силикатных стекол. [23] |
Наиболее распространенным и практически значимым классом стекол являются оксидные стекла. Основным параметром, который используется в качестве классификационной основы, является природа стеклообразующего оксида. Уже было показано, что типичными стеклообразователями являются В203, SiCb, GeCb, P2O5, а также оксиды AS2O3, 5ЬгОз, ТеОз, которые переходят в стеклообразное состояние при быстром охлаждении. [24]
Цвет стекла зависит также от количества содержав-шегбся-в-нем красящего оксида. Сильное изменение окраски вызывается, кро - шГтого, различным содержанием в стекле отдельных стеклообразующих оксидов. Особенно сильно влияют щелочи ( оксид натрия, оксид калия), а также оксед свинца и оксид бора. Оксид меди, например, в известково-натриевом стекле дает голубой цвет, а в цинково-калие-вом - зеленый. Оксид марганца в первом стекле дает красно-фиолетовую окраску, а во втором - сине-фиолетовую. Оксид свинца чрезвычайно усиливает цвет стекла и дает особенно яркие оттенки. Наиболее выразительно окрашиваются свинцово-калиевые стекла. Борная кислота также сильно изменяет цвет окрашенных стекол, однако действие ее в зависимости от красителей различное. [25]
Стекло способно образовывать называемые стеклообразующими оксиды SiO2, Р2О5 и В2О3 без каких либо добавок. Однако в большинстве случаев сырьевой массой для производства стекол является многокомпонентная шихта, содержащая помимо стеклообразующего оксида различные добавки. [26]
В состав неорганических стекол входят стеклообразующие оксиды кремния, бора, фосфора, германия, мышьяка, образующие структурную сетку и модифицирующие оксиды натрия, калия, лития, кальция, магния, бария, изменяющие физико-химические свойства стекломассы. Кроме того, в состав стекла вводят оксиды алюминия, железа, свинца, титана, бериллия и др., которые самостоятельно не образуют структурный каркас, но могут частично замещать стеклообразующие оксиды и этим сообщать стеклу нужные технические характеристики. В связи с этим промышленные стекла являются сложными многокомпонентными системами. [27]
Первая группа параметров, отраженная в табл. 4.7, показывает, что для стеклообразующих катионов типичны высокие заряды ионов, малые значения ионных радиусов и координационных чисел, и, как следствие, высокая напряженность поля. Для элементов-модификаторов, напротив, характерны низкие заряды ионов, большие ионные радиусы и координационные числа в сочетании с низкой напряженностью поля. Для стеклообразующих оксидов характерны высокие значения прочности химической связи. [28]
Действительно, интенсивность процесса перегруппировки атомов, происходящего во время кристаллизации материала и сопровождающегося разрывом отдельных связей и образованием новых межатомных связей, будет зависеть от прочности связей. Прочность единичных связей стеклообразующих оксидов превышает, по Сану, 376 8 кДж / моль, прочность связей оксидов-модификаторов - менее 251 2 кДж / моль. [29]
Страницы: 1 2 3