Солеобразующий оксид
Cтраница 3
Оксиды неметаллов делятся на две группы: несоле-образующие и солеобразующие оксиды. К несолеобра-зующим оксидам относятся: SiO, N20, NO, CO. Все остальные оксиды неметаллов являются солеобразующи-ми. Солеобразующие оксиды неметаллов относятся к типу кислотных оксидов. [31]
Высшие кислородные соединения SeO3 и ТеО3, подобно SO3, представляют собой солеобразующие оксиды селеновой H2SeO4 и теллуровой Н2ТеО4 кислот. [32]
СО NaOHpacnjiaB P HCOONa; реакция а) - окислительно-восстановительная, тогда как обычные солеобразующие оксиды взаимодействуют со щелочами ( или кислотами) без изменения степени окисления атомов элементов, участвующих в реакции. [33]
Оксиды разделяются на солеобразующие и несоле-образующие ( последних довольно мало - СО, NO, N2O) Солеобразующие оксиды делятся на кислотные, основ-ные и амфотерные. [34]
В следующей своей работе О количестве кислорода в соляных окислах и об атомности элементов ( 1870) Д. И. Менделеев показал, что высшая валентность элемента в солеобразующем оксиде также есть периодическая функция от атомной массы. [35]
Оксиды подразделяются на несолеобразующие ( безразличные) и солеобразующие. Солеобразующие оксиды делятся на основные, кислотные и амфотерные. [36]
Солеобразующие оксиды в свом очередь подразделяются на основные, кислотные и амфотерные. Основным оксидам отвечают основания, кислотным - кислоты. Амфотерным оксидам отвечают гидраты, проявляющие и кислот-лые, и основные свойства. Безразличные оксиды не образуют ни кислот, ни оснований. [37]
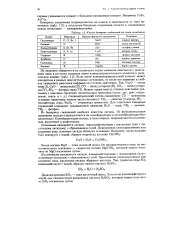 |
S. Классы бинарных соединений от типа неметалла. [38] |
Из бинарных соединений наиболее известны оксиды. Солеобразующие оксиды, в свою очередь, подразделяются на основные, кислотные и амфотерные. [39]
Оксиды делятся на солеобразующие и несолеобразую-щие. К солеобразующим оксидам относят основные, кислотные и амфотерные. Им соответствуют основания, кислоты и гидроксиды с амфотерными свойствами. [40]
 |
Шестая группа периодической системы. [41] |
Для всех элементов VI группы периодической системы, кроме кислорода, высшая степень окисления равна шести. Этому соответствуют их высшие солеобразующие оксиды типа RO3 ( SO3, SeO3, TeO3, CrO3, МоО3 и др.), проявляющие кислотные свойства. [42]
Укажите, какие неорганические вещества называют оксидами. Что лежит в основе разделения оксидов на соле - и несолеобразующие; по каким химическим свойствам солеобразующие оксиды делятся на основные, кислотные и амфотерные. [43]
В этой таблице впервые появляются 8 групп элементов. Группа - это совокупность элементов, имеющих, как правило, валентность по кислороду в их высших солеобразующих оксидах, равную номеру группы. Общие формулы этих оксидов приведены Д. И. Менделеевым внизу под номером группы. [44]
Немногочисленные несолеобразующие оксиды не взаимодействуют ни с кислотами, ни с основаниями. К ним относятся оксид азота ( I) N2O, оксид азота ( II) NO и др. Солеобразующие оксиды делятся на основные, кислотные и амфотерные. [45]
Страницы: 1 2 3 4