Оксид-ионы
Cтраница 1
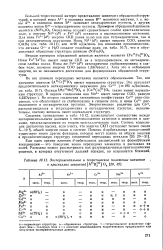 |
Экспериментальное и теоретическое положение катионов в кристаллах шпинелей ( А1 1 О4. [1] |
Оксид-ионы создают сравнительно слабое кристаллическое поле, и поэтому Ni2 ( d8) и Fe3 ( d5) остаются в высокоспиновом состоянии. Для иона Fe3 ( d5) энергия СКП равна нулю как при тетраэдрическом, так и при октаэдрическом окружении. [2]
Катализаторами щелочного гидролиза служат гидр - оксид-ионы. [3]
Иногда соли содержат в своем составе также гидроксид-или ( и) оксид-ионы; такие соли называют основными солями. [4]
В расплаве образуются сложные анионы, содержащие одновременно кислород и фтор, например типа A1F403 -, а не оксид-ионы. [5]
Многоядерные соединения, в комплексных анионах которых содержатся центральные атомы разных элементов, а в качестве лигандов, в том числе и мостиковых, выступают оксид-ионы О2 -, называют гетерополисоединениями. [6]
Многоядерные соединения с комплексными анионами, в которых комплексообразова-телями являются атомы одного и того же элемента, а в качестве лигандов ( в том числе и мостиковых) выступают оксид-ионы О2 -, называют изополисоединениями. [7]
Недостаток оксида алюминия в том, что на нем могут протекать реакции превращения многих растворенных веществ, катализируемые основаниями, особенно если оксид алюминия активирован при высоких температурах. Сильнокислые компоненты могут хемисорбироваться оксидом алюминия ( энергия адсорбции сравнима с энергией образования связи в химической реакции); сложные эфиры и ангидриды могут омыляться; альдегиды и ке-тоны конденсироваться; может меняться положение двойных связей; наконец, может происходить потеря галогеноводородов. Ацетон, в частности, может реагировать с гидроксидом алюминия и поэтому не должен применяться в качестве растворителя при работе с этим адсорбентом. Чаще всего используют низкотемпературный ( 200 С) неочищенный Y-ОКСИД алюминия с площадью поверхности от 100 до 200 м2 / г. Обычно полагают, что в поверхностном слое находятся оксид-ионы ( О2 -), а ионы алюминия ( А13) - в нижележащем слое. Вода может присутствовать или в виде гид-роксильных групп или в адсорбированном виде. При нагревании до 300 С удаляется большая часть адсорбированной воды и происходит реакция образования гидроксильных групп, которые, в свою очередь, можно удалить при нагревании до 800 С. При высоких температурах ( 1100 С) образуется сс-оксид алюминия, который имеет малую поверхность и хроматографически неактивен. [8]
 |
Окисление СО. Поперечное сече-ние плоскости ( 001 кристаллической ре.| Окисление СО. Проекция пло-скости ( 011 кристаллической решетки за. [9] |
Следовательно, закись меди имеет такое геометрическое строение, что мы можем с достаточным основанием ожидать сравнительно легкого протекания кислородного обмена на всех трех основных геометрических плоскостях. В решетке NiO такое удобное для реакции обмена расположение ионов кислорода отсутствует, и ионы никеля, находящиеся на гладкой плоскости ( 111), до некоторой степени недоступны для реакции. На основании сказанного делается понятным, почему при использовании NiO наблюдается меньшая, чем в случае Си20, активность катализатора в реакции кислородного обмена с СО и С02 - Другое подтверждение этого положения вытекает из работы Тешнера [19-21], который обнаружил, что СО и С02 вступают в реакцию кислородного обмена с не подвергнутой спеканию закисью никеля NiO, имеющей большую удельную поверхность. Если NiO приготовлена именно таким образом, то можно ожидать, что в этом случае будет достаточно ионов кислорода, удобно расположенных для реакции обмена с кислородом газовой фазы. Кроме того, при этом наблюдается повышенная хемосорбция СО, и причиной такого увеличения активности опять могут быть подвижные оксид-ионы. [10]
Было найдено, что при растворении в воде облученных кристаллов какие-то радикалы, стабилизирующие решетку и содержащие радиоактивный марганец, реагируют так, что соотношение вновь образуемых перманганат-ионов зависит от рН раствора. Следует ожидать, что при растворении такой ион будет либо восстановлен с осаждением двуокиси марганца МпО2, либо взаимодействовать с ионами гидроксила, вновь образуя перманганат. Он предположил, что распределение электронов на молекулярных орбиталях между атомом отдачи и присоединенными к нему атомами кислорода является таким же, как и в нормальных содержащих кислород анионах. В зависимости от соотношения величин электроотрицательности атома отдачи и кислорода в процессе отдачи будут теряться либо атомы кислорода, либо оксид-ионы. Когда теряются оксид-ионы, отделение по Сцилларду-Чалмерсу будет возможным только в том случае, если осколки отдачи восстанавливаются водой быстрее, чем протекает реакция их гидратации. [11]
Было найдено, что при растворении в воде облученных кристаллов какие-то радикалы, стабилизирующие решетку и содержащие радиоактивный марганец, реагируют так, что соотношение вновь образуемых перманганат-ионов зависит от рН раствора. Следует ожидать, что при растворении такой ион будет либо восстановлен с осаждением двуокиси марганца МпО2, либо взаимодействовать с ионами гидроксила, вновь образуя перманганат. Он предположил, что распределение электронов на молекулярных орбиталях между атомом отдачи и присоединенными к нему атомами кислорода является таким же, как и в нормальных содержащих кислород анионах. В зависимости от соотношения величин электроотрицательности атома отдачи и кислорода в процессе отдачи будут теряться либо атомы кислорода, либо оксид-ионы. Когда теряются оксид-ионы, отделение по Сцилларду-Чалмерсу будет возможным только в том случае, если осколки отдачи восстанавливаются водой быстрее, чем протекает реакция их гидратации. [12]
Страницы: 1