Окситрихлорид - ниобий
Cтраница 1
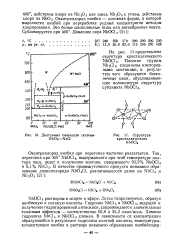 |
Диаграмма плавкости системы. [1] |
Окситрихлорид ниобия при перегонке частично разлагается. [2]
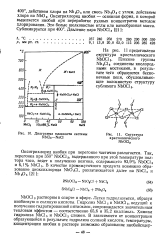 |
Диаграмма плавкости системы NbCls-NaCl. [3] |
Окситрихлорид ниобия - основная форма, в которой выделяется ниобий при переработке рудных концентратов методом хлорирования. [4]
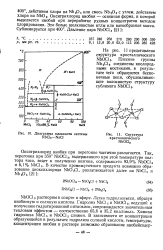 |
Диаграмма плавкости системы NbCls-NaCl. [5] |
Окситрихлорид ниобия при перегонке частично разлагается. [6]
Окситрихлорид ниобия образует шелковистые бесцветные игольчатые кристаллы, которые очищают перегонкой при 332 в атмосфере С02 или водорода. Нагреванием при высокой температуре в атмосфере С02 или Н2 NbOCl3 превращается в Nb205 и NbCl5; на воздухе он окисляется до Nb205, растворяется в H2S04, конц. [7]
При нагревании окситрихлорид ниобия не плавится, но может возгоняться при 200 С в вакууме или в токе кислорода. При несколько более высоких температурах он разлагается. Форма кристаллов окситрихлорида ниобия в значительной степени зависит от метода его получения. Если он конденсируется на поверхности, нагретой до 100 С, то кристаллы имеют форму игл или розеток диаметром в несколько миллиметров. В одной из работ описан окситрихлорид ниобия с волокнистой структурой, который при нагревании до 350 С в запаянном кварцевом капилляре в атмосфере аргона и медленном охлаждении образует монокристаллы. [8]
Электрофильный характер окситрихлоридов ниобия и тантала выражен слабее, чем у пентахлоридов. Окси-трихлорид ниобия растворим в эфире, 1 4-диоксане, алифатических спиртах, пиридине и нитробензоле, но нерастворим в бензоле и че-тыреххлористом углероде. [9]
Технический хлорид ниобия, получающийся при хлорировании концентратов пирохлора, состоит в основном из окситрихлорида ниобия МЬОС13 ( частично образуется и NbCls) и загрязнен примесями хлоридов Fe, Al, Zr, Ti, Si. От основной массы хлоридов хлориды ниобия очищают при их фракционной конденсации вследствие различающихся температур кипения и давления паров. Очистка NbOCl3 и NbCl5 от примеси РеС13 и ZrCl4 затруднительна вследствие близости температур кипения. [10]
Окситрибромид ниобия - желто-коричневое кристаллическое твердое вещество, дымящее на влажном воздухе. Хотя и не появлялось сообщений об измерении действительных давлений пара окситрибромида, сравнительная легкость, с которой он возгоняется в вакууме, дает основания считать, что даже при довольно низких температурах ( 200е С) отделить его от пента-бромида ниобия будет значительно труднее, чем окситрихлорид ниобия от пентахлорида. Это соединение термически устойчиво до 310 С. Но при 320 С в вакууме появляются первые признаки разложения на пятиокись и пентабромид. [11]
При нагревании окситрихлорид ниобия не плавится, но может возгоняться при 200 С в вакууме или в токе кислорода. При несколько более высоких температурах он разлагается. Форма кристаллов окситрихлорида ниобия в значительной степени зависит от метода его получения. Если он конденсируется на поверхности, нагретой до 100 С, то кристаллы имеют форму игл или розеток диаметром в несколько миллиметров. В одной из работ описан окситрихлорид ниобия с волокнистой структурой, который при нагревании до 350 С в запаянном кварцевом капилляре в атмосфере аргона и медленном охлаждении образует монокристаллы. [12]
При нагревании окситрихлорид ниобия не плавится, но может возгоняться при 200 С в вакууме или в токе кислорода. При несколько более высоких температурах он разлагается. Форма кристаллов окситрихлорида ниобия в значительной степени зависит от метода его получения. Если он конденсируется на поверхности, нагретой до 100 С, то кристаллы имеют форму игл или розеток диаметром в несколько миллиметров. В одной из работ описан окситрихлорид ниобия с волокнистой структурой, который при нагревании до 350 С в запаянном кварцевом капилляре в атмосфере аргона и медленном охлаждении образует монокристаллы. [13]
Страницы: 1