Оксонитрат
Cтраница 1
Оксонитрат изоструктурен соединению BisO... [1]
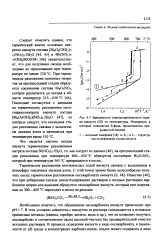 |
Зависимость электропроводности оксида висмута ( III от температуры. Измерения, в которых появляется р-фаза, представлены прерывистой линией. [2] |
С образуется оксонитрат Bi5O7NO3, который при температуре 565 С превращается в оксид. [3]
В присутствии ионов Li магний отделяют в виде оксонитрата или MgO. При этом из полученного остатка не должны выделяться газообразные нитрозосо-динения и соли аммония. Затем к осадку, измельченному при помощи стеклянной палочки, добавляют воду. Раствор упаривают почти наполовину, переносят в центрифужную пробирку и центрифугируют. [4]
Примеры: Bi ( OH) 2NO3 - гидроксонитрат висмута; BiONO3 - оксонитрат висмута. [5]
Обнаружение ионов Na и других щелочных металлов проводят в центрифугате, полученном после осаждения магния ( оксонитрата магния), или в водной вытяжке исходного анализируемого вещества. [6]
Однако, по данным Кодамы [46], при температуре 400 - 450 С Bi ( NO3) 3 - 5H2O разлагается до оксонитрата состава Bi5O7NO3, который переходит в a - Bi2O3 при температуре выше 565 С. [7]
Последние разлагаются в интервале 100 - 300: С, ионные-при 400 - 600 С ( КаМО3, КЖ3 и нек-рые др. при нагр. Продуктами разложения в твердой н жидкой фазах являются последовательно нитриты, оксонитраты и оксиды, иногда-своб. Состав продуктов разложения зависит от природы металла и его степени окисления, скорости нагревания, т-ры, состава газовой среды и др. условий. [8]
Из производных, отвечающих основной функции гидроокисей Э ( ОН) з, лучше других изучены сульфаты и фосфаты. Для ниобия описаны оксосульфаты № 204804, Nb2O3 ( SO4b и Nb2O ( SO4) 4, а для тантала - даже нормальный сульфат Ta2 ( SO4) s - Известны также оксонитраты ЭО ( МОз) з - Водой все эти бесцветные кристаллические вещества легко гидролизуются. Сухим путем были получены нерастворимые в воде оксо-фосфаты ЭОРО4 и нормальные фосфаты Э3 ( РО4Ь обоих элементов. [9]
Оксид AgO получается при медленном добавлении раствора AgNO3 к раствору персульфата щелочного металла, он представляет собой черный кристаллический порошок, который является полупроводником и диамагнетиком. В результате электролиза водного раствора AgNO3 с платиновым анодом получается соединение с эмпирической формулой Ag7NOn, образующее черные кубические кристаллы с металлическим блеском. Это соединение является оксонитратом Ag ( Ag6O8) NO. [10]
Действием фтора при 400 С под давлением на ReF6 был получен бледно-желтый ReF. Молекула ренийгептафторида имеет строение несколько искаженной пентагональной бипирамиды с d ( ReF) l 83A в плоскости кольца и 1 84 А перпендикулярно к ней. Лучше других из чен желтый FReO3, который может быть получен взаимодействием KReO4 и IFs. Для ReO2F3 были получены двойные соединения с фторидами ряда одновалентных и двухвалентных металлов. Исходя из этого хлорида ( и N205), был получен бледно-желтый оксонитрат ReO3NO3, в отсутствие влаги ниже 70 С довольно устойчивый. Все оксо-соединения рения легко разлагаются водой. [11]
Страницы: 1