Оксосоль
Cтраница 1
 |
Диаграмма растворимости в системе FeSO. - Н2О. [1] |
Оксосоль Fe2O ( SO4) 2 при 400 - 450 С разлагается с образованием рентгеноаморфного оксида железа и соединения Fe4O ( 804) 5, которое превращается в a - Fe2O3 с выделением серного ангидрида в газовую фазу. [2]
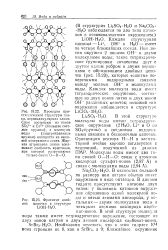 |
Проекция кристаллической структуры гипса, перпендикулярная слоям. Слои построены из ионов SO42 - и Са2 ( большие свет.| Фрагмент двойной цепочки в структуре LiOH - H2O. [3] |
В оксосолях большой по размеру ион натрия обычно имеет окружение в виде октаэдра. В данном гидрате присутствуют катионы двух типов: у половины катионов окружение образовано одной молекулой воды и пятью атомами кислорода, у остальных - двумя молекулами воды и четырьмя атомами кислорода карбонат-ионов. [4]
В отличие от бескислородных солей ( см. рубрику 7.2) называются кислородсодержащими солями или оксосолями. По составу катионов и анионов делятся на средние, кислые, основные и двойные соли. [5]
Подобного рода соли называют гидроксосолями, в отличие от солей, содержащих такие анионы, как SO -, CO - и др., называемых оксосолями. [6]
Подобного рода соли называют гидроксисолями, в отличие от солей, содержащих такие анионы, как SC4 -, СО3 -, NO3 - и др., называемых оксосолями. [7]
Структурная химия бинарных соединений ванадия в различных степенях окисления ( II-V) уже была описана в предыдущей главе; особенно это касается необычной координации ванадия ( V) атомами кислорода в оксидах и оксосолях, где кроме тетраэдрического встречается квадратно-пирамидальный или искаженно-октаэдрический многогранники ( см. разд. [8]
 |
Окружение молекул воды в кристаллах. Большие заштрихованные кружки - М, ОН -, F - или атомы кислорода кислородсодержащих ионов. [9] |
ОН-группы поляризуются до такой степени, что образуются связи О - Н - О; аналогичный эффект наблюдается и в гидратах. В гидратированных оксосолях и гидроксидах короткие расстояния ( 2 7 - - 2 9 А) между атомами кислорода молекул воды и атомами кислорода оксо-ионов похожи на аналогичные расстояния, найденные в структурах некоторых гидроксидов и гидроксид-оксидов, что свидетельствует об образовании водородных связей. Отдельно мы рассмотрим гидраты кислот и кислых солей, в которых протоны связаны с некоторыми ( или всеми) молекулами воды с образованием катиона оксония Н30 или более сложных группировок. [10]
Соединения, в которых с атомами кислорода непосредственно связаны атомы различных элементов, сходных по их отношению к кислороду, относятся к двойным нормальным оксидам. Значительным различием отношения элементов к кислороду объясняется переход двойного оксида в оксосоль. [11]
Соединения, в которых с атомом кислорода непосредственно связаны атомы различных элементов, сходных по их отношению к кислороду, являются двойными нормальными оксидами. Если же элементы различны по их отношению к кислороду, то образуется оксосоль. [12]
Тип искажения координационного полиэдра, обусловленный присутствием неподелеппон пары, очень чувствителен к геометрии и топологии всей структуры в целом, что подтверждается тем фактом, что в одном и том же кристалле могут присутствовать координационные полиэдры олова различных типов: двух типов в a - SnF2, Sn2OF2 н SnmWisOto [19] и трех - - - v, Sn3 ( PO4) 2 Г2 1 - в этом ортофосфате, как и в Sn2OF2 п TIBO3l свободные электронные пары располагаются внутри каналов; структуры. Геометрия таких структур в целом с учетом расположения ближайших соседей атома металла, а также вычисление молекулярного объема, занимаемого анионом в некоторых оксидах, оксосолях и фторидах, показывают, что неподелснные. Было предложено два способа систематизации кристаллохимии Sn ( II) и других элементов с неподеленной парой. [13]
Следует отметить, что обратное диагональное сходство наблюдается значительно реже. В частности, оно может отсутствовать там, где имеет место прямое диагональное сходство. В то же время элементы, лежащие на обратной диагонали по обе стороны от германия - In и Р, образуют типичную оксосоль с островными радикалами Р0 - и катионами 1п3 в шестерной координации, что и понятно из-за большой разности СХ In и Р, приводящей к значительно более прочной донорно-акцепторной связи Р - О по сравнению с In - О. [14]
Страницы: 1