Определение - растворимость
Cтраница 2
Определение растворимости и критической температуры растворения для четыреххлористого кремния и ряда органических растворителей выполняют при пониженных температурах в сосуде Дьюара с мешалкой. После перемешивания и отстаивания разделяют и анализируют жидкие фазы. На основании данных анализа строят кривые равновесия в пределах от - 70 до 10 С. [16]
Определение растворимости оказывается особенно полезным в тех случаях, когда в состав анализируемого вещества входят примеси, содержание которых трудно определить методами химического анализа. [17]
Определение растворимости с помощью сокристаллизации основано на нахождении коэффициента равновесного распределения примеси, образующей твердый раствор замещения, между кристаллами и материнской фазой. [18]
Определение растворимости оказывается особенно полезным в тех случаях, когда в состав анализируемого вещества входят примеси, содержание которых трудно определить методами химического анализа. [19]
Определение растворимости состоит в растворении испытуемого образца растворителем ( бензолом), последующем фильтровании раствора и определении весовым способом растворимости битума в процентах. [20]
Определение растворимости с помощью радиоактивных индикаторов может быть осуществлено различными вариантами: прямым определением методом изотопных радиоактивных индикаторов; методом изоморфного индикатора; методом изотопного разбавления; методом Неймана; методом радиометрического титрования. [21]
Определение растворимости производится с отдельными пробами - 1 - 2 микрошпателями исследуемого вещества. При этом последовательно в разных про бирках определяется растворимость пробы вещества в воде, разбавленной и концентрированной соляной кислоте, в разбавленной и концентрированной азотной кислоте, царской водке, растворах щелочей и аммиака. Если количество исследуемого вещества ограничено, можно уменьшить число отдельных проб. Так, если проба вещества не растворяется в нескольких каплях воды, можно к ней же добавить 2 - 3 капли разбавленной, а при необходимости и концентрированной соляной кислоты. В другой пробе можно испытать отношение вещества к 2 - 3 каплям разбавленной азотной кислоты, а затем, в случае надобности, последовательно добавлять по каплям концентрированные кислоты - сначала азотную, а затем соляную. [22]
Определение растворимости их дало значения 2 4 - 10 - 3 % и соответственно 4 - 10 - 2 %, но возможно, что столь низкие значения получены из-за чрезвычайной медленности растворения. [23]
Определение растворимости производится с отдельными пробами - 1 - 2 микрошпателями исследуемого вещества. При этом последовательно в разных пробирках определяется растворимость пробы вещества в воде, разбавленной и концентрированной соляной кислоте, в разбавленной и концентрированной азотной кислоте, царской водке, растворах щелочей и аммиака. Если количество исследуемого вещества ограничено, можно уменьшить число отдельных проб. Так, если проба вещества не растворяется в нескольких каплях воды, можно к ней же добавить 2 - 3 капли разбавленной, а при необходимости и концентрированной соляной кислоты. В другой пробе можно испытать отношение вещества к 2 - 3 каплям разбавленной азотной кислоты, а затем, в случае надобности, последовательно добавлять по каплям концентрированные кислоты - сначала азотную, а затем соляную. [24]
Определения растворимости проводили при таких заполнениях ампулы, чтобы в момент исчезновения последнего кристаллика твердой фазы осъсм газовой фазы был мал по сравнению с объемом жидкой фазы и количествами веществ в газовой фазе можно было пренебречь. [25]
Определение растворимости СаС12 в растворах НС1 различной концентрации при 25 С и других температурах, Отч. [26]
Определение растворимости проводят с малыми количествами испытуемого вещества. Часть водного экстракта собирают на часовое стекло и выпаривают на водяной бане. [27]
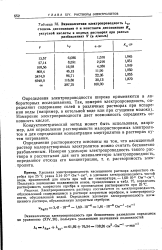 |
Эквивалентная электропроводность Kv. [28] |
Определения растворимости основаны на том, что насыщенный раствор малорастворимых электролитов можно считать бесконечно разбавленным. [29]
Определение растворимости проводят с малыми количествами испытуемого вещества. [30]
Страницы: 1 2 3 4