Определение - растворимость - соль
Cтраница 2
Это свойство системы было нами использовано при приготовлении исходных растворов для изучения скорости кристаллизации СаНРО4 2Н2О и определения растворимости соли. Приготовленные при низкой температуре растворы тщательно отфильтровывались и из них отбирали пробы для анализа. [16]
 |
Схематическое изображение кривых р - t для установления давлений при равновесиях в верхней трехфазной области в системах 2-го типа. [17] |
Кривые р - t использовались для установления температур и давлений, соответствующих равновесиям в верхней трехфазной области, и в некоторых случаях для определения растворимости солей во флюидной фазе. [18]
Искусственно полученные радиоактивные изотопы ( меченые атомы) различных элементов используются при контроле разделения осаждением, экстрагированием ( извлечением), адсорбцией ( поглощением), электролизом и другими способами, а также для определения растворимости солей, выяснения полноты осаждения, изучения адсорбции и соосаждения, экстрагирования, определения устойчивости комплексных соединений. [19]
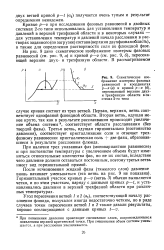 |
Схематическое изображение изотермы фазовых равновесий в координатах р-х ( а и кривой р - v ( б, пересекающей верхние двух-и трехфазную области в системах 2-го типа. [20] |
Кривые р - v при исследовании фазовых равновесий в двойных системах 2-го типа использовались для установления температур и давлений в верхней трехфазной области и в некоторых случаях - для установления температур и давлений начала расслоения в растворах заданного ( по загрузке) состава ( верхняя двухфазная область), а также для определения растворимости соли во флюидной фазе. [21]
 |
Схематическое изображение кривых р-х Ац. я установления концентрации и давления пара насыщенных растворов в системах 1-го типа. [22] |
Экспериментально определялись: давление пара в процессе изотермического испарения ( кривые р-х), зависимость давления от температуры ( кривые р - t), зависимость давления от увеличения объема при постоянной температуре ( кривые р - v), зависимость температуры от увеличения объема при постоянном давлении ( кривые t - v), и, кроме того, для определения растворимости солей во флюидной фазе измерялась величина падения давления, наблюдающегося при растворении кристаллической соли, в зависимости от состава исходного или получающегося раствора. [23]
 |
Результаты анализа продажных препаратов фосфата. [24] |
Этот способ наиболее отвечает аналитическим требованиям для определения растворимости солей слабых кислот. Кроме того, для аналитической практики важно знать величину растворимости фосфатов в зависимости от рН раствора. [25]
 |
Результаты анализа продажных препаратов фосфата. [26] |
Этот способ наиболее отвечает аналитическим требованиям для определения растворимости солей слабых кислот. Кроме того, для аналитической практики важно знать величину растворимости фосфатов в атзпгпмости от рН раствора. [27]
Для определения концентрации растворов в основном используются пламенные источники атомизации и возбуждения. Несмотря на ряд ограничений, пламенно-эмиссионный метод остается одним из самых простых и чувствительных методов определения растворимости солей легко возбуждаемых элементов - щелочных и щелочно-земельных металлов [182-186] и некоторых переходных элементов [187, 188] как в водных, так и в неводных растворителях. Предел обнаружения порядка 0 1 - 1 нг мл - достигается также для таких элементов, как европий, иттербий, свинец, медь, серебро, индий, таллий, хром, марганец, алюминий. [28]
Хотя полученные по определению растворимости ртути в воде и водных растворах солей данные нельзя считать очень точными ( разброс точек довольно значителен), тем не менее они определенно показывают, что переходящие в раствор количества ртути относительно невелики и с увеличением концентрации соли быстро уменьшаются. Вообще они меньше тех количеств, которые переходят в вакуум при испарении ртути, а потому не отражаются на результатах определений растворимости солей во флюидной фазе. [29]
Под потенциометрией понимается ряд методов анализа и определения физико-химических характеристик электролитов и химических реакций, основанных на измерении электродных потенциалов и электродвижущих сил гальванических элементов. Потенциометрические измерения являются наиболее надежными при изучении констант равновесия электродных реакций, термодинамических характеристик реакций, протекающих в растворах, определении растворимости солей, коэффициентов активности ионов, рН растворов. Особенно обширное применение нашли потенциометрические измерения именно при определении рН, которое является важнейшей характеристикой жидких систем. К таким электродам относятся, например, рассмотренные ранее водородный и стеклянный электроды. [30]
Страницы: 1 2 3