Определение - теплота - образование
Cтраница 1
Определение теплот образования по энергиям связей для ароматических соединений не дает удовлетворительных результатов. [1]
Определение теплот образования некоторых фторхлорзамещенных метана методом взрыва в сферической бомбе, Сб. [2]
Определение теплот образования по энергиям связей для ароматических соединений не дает удовлетворительных результатов. [3]
Определение теплоты образования радикала NH2, Д / / овР ( NH2, газ) 44 2 ккал / моль, о чем уже говорилось выше, и использование величины Д / / овР ( МНз, газ) - 11 09 ккал / моль приводит к значению D ( H2N - - Н) 107 ккал / моль. [4]
Определение теплоты образования кристаллогидрата, которое сводится к определению теплот растворения безводной соли и ее кристаллогидрата. [5]
Определение теплоты образования нитрозилперхлората приведено в работе Крузе и др. [34], однако результат этого определения явно ошибочен. [6]
Определение теплот образования фосфидов цинка / проводили в калориметре Бертло; для сжигания применяли бомбу Крекера. [7]
Определение теплот образования солей ароматических сульфокислот описано в главе IV ( стр. [8]
Определению теплоты образования InP посвящена работа [2], в которой сделана попытка разложения соединения Б калориметрической бомбе. [9]
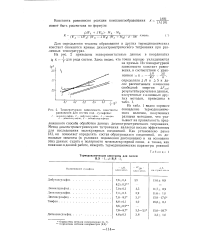 |
Температурная зависимость константы равновесия для систем иод - сульфиды. [10] |
Для определения теплоты образования и других термодинамических констант снимаются кривые диэлектрометрического титрования при различных температурах. [11]
Для определения теплоты образования из простых веществ необходимо определить теплоту сублимации 5 атомов углерода ( - 125 ккал / г-атом), теплоту диссоциации двух молекул азота, шести молекул кислорода и четырех молекул водорода. [12]
Для определения теплоты образования соединения по уравнению ( 1) необходимо знать радиус комплексного иона [ SnCl6 ] 2 - и теплоту его образования в газообразном состоянии. [13]
Для определения теплоты образования соединения по уравнению ( 1) необходимо знать радиус комплексного иона ( SnG6 ] 2 - и теплоту его образования в газообразном состоянии. [14]
Для определения теплот образования соединений, экспериментальное изучение которых очень сложно, мы использовали методы, дающие косвенную термохимическую информацию. Так, расчет теплот образования метил - и этилхлорсиланов [2] вели по константам равновесия реакций диспропорционирования. Равновесие реакций диспропорционирования метил - и этилхлорсиланов было изучено экспериментально в статических условиях. [15]
Страницы: 1 2 3 4