Количественное определение - соль
Cтраница 1
Количественное определение солей многих органических кислот производят методом вытеснения, где основание, связанное со слабой или малорастворимой кислотой, титруется сильной кислотой, которая вытесняет слабую. Он дает удовлетворительные результаты в тех случаях, когда вытесняемая органическая кислота имеет малую константу диссоциации. Соли сильных кислот, константы диссоциации которых приближаются к величине 10 - 4, не могут быть точно оттитрованы. Выбор индикатора определяется величиной рН в эквивалентной точке, когда слабая кислота полностью замещена сильной. [1]
Количественное определение солей хинина по Ф1Х производится методом нейтрализации. [2]
Количественное определение солей серной кислоты и сернистой может быть произведено весовым путем, для чего подкисленный соляной кислотой водный раствор экстрагируется эфиром для удаления масел ( обратное промывание эфира водой) и после прибавления кристаллика КСЮз осаждается хлористым барием. [3]
Для количественного определения соли алкалоида в препарате берут колонку катионита в Н - форме и фильтруют через нее раствор со скоростью примерно 0 1 мл / сек. Затем колонку промывают 40 мл воды до исчезновения кислой реакции и титруют фильтрат щелочью. [4]
Для количественного определения соли трехвалентного железа учащиеся используют цветную реакцию с сульфосалициловой кислотой. Из точной навески железоаммонийных квасцов готовят эталонный раствор, содержащий, например, 0 1 г железа в литре. Как и в предыдущем анализе, раствор подкисляют, чтобы не допустить гидролиза соли железа. В ряд мерных колб помещают определенные порции эталонного раствора, добавляют в каждую 10 % - ный водный раствор сульфосалициловой кислоты и 25 % - ный водный раствор аммиака, перемешивают и доливают дистиллированной водой до метки. [5]
Для количественного определения соли алкалоида берут колонку катионита, содержащую примерно двойное количество последнего, необходимое для поглощения основания алкалоида из данного раствора. Раствор соли алкалоида фильтруют через колонку со скоростью примерно 0 1 мл / сек. Затем катионит промывают 30 - 40 мл воды до исчезновения кислой реакции в промывных водах. Свободная кислота в фильтрате определяется титрованием щелочью, а затем рассчитывается количество соли алкалоида. [6]
Для количественного определения соли алкалоида берут колонку катионита, содержащую примерно двойное количество последнего, необходимое для поглощения основания алкалоида из данного раствора. Раствор соли алкалоида фильтруют через колонку со скоростью примерно 0 1 мл / сек. Затем катионит промывают 30 - 40 мл воды до исчезновения кислой реакции в промывных водах. Свободная кислота в фильтрате определяется титрованием щелочью, а затем рассчитывается количество соли алкалоида. [7]
Методы количественного определения солей органических кислот разнообразны и специфичны. Обычно соли титруют растворами хлорной кислоты ( НС1О4) в органических растворителях в присутствии уксусной кислоты. [8]
Приведенные выше исследования позволили разработать метод количественного определения солей алкалоидов и солей других органических оснований, отличающийся высокой точностью, несложностью выполнения и заключающийся в следующем. [9]
Разработанный нами метод ионообменной адсорбции для количественного определения солей алкалоидов оказался вполне применимым к анализу лекарственных смесей, содержащих соли алкалоидов. [10]
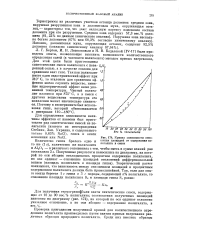 |
Кривая зависимости отношения площадей от содержания полигалита в смеси. [11] |
IV-17 ] были проведены опыты, позволяющие выяснить возможности количественного определения солей ( в частности полигалита) методом кривых нагревания. Для этой цели были приготовлены синтетические смеси полигалита с нова - sn / st ренной солью, а в качестве эталона для сравнения взят гипс. Так как полигалит имеет один эндотермический эффект при 310 С, то эталоном для сравнения эффектов могло служить вещество, имеющее эндотермический эффект ниже указанной температуры. Чистый полигалит плавится при 875 С, а в смеси с другими веществами температура его плавления может значительно снизиться. Поэтому в эксперименте был использован гипс, который обезвоживается в интервале НО-180 С. [12]
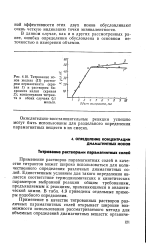 |
Титрование ионов железа ( II раствором перманганата ( кривая 1 и раствором би-хромата калия ( кривая 2. концентрация титран-та в обоих случаях 0 1 моль / л. 60 50 ъ W 3 И зо л 20 10. [13] |
Применение растворов парамагнитных солей в качестве титрантов может широко использоваться для количественного определения различных диамагнитных солей. Единственным условием для такого определения является соответствие термодинамических и кинетических параметров выбранной реакции общим требованиям, предъявляемым к реакциям, применяющимся в аналитической химии. В табл. 4.9 приведены отдельные примеры подобного определения. [14]
В этих работах описаны формы кривых титрования некоторых солей и приведены значения констант диссоциации слабых электролитов, допускающие количественное определение солей при различных концентрациях. [15]
Страницы: 1 2