Бихроматы
Cтраница 2
Бихроматы и хроматы находят широкое применение в химической промышленности ( окислители), кожевенной, текстильной ( протравы и др.) - Они находят также применение как ингибиторы ( в нейтральной среде) и деполяризаторы ( в кислой среде) и в ряде других областей. [16]
Бихроматы окисляют полиамид, в результате чего образуется сшитая сетчатая структура с повышенной стойкостью в травящем растворе и с повышенной адгезией. [17]
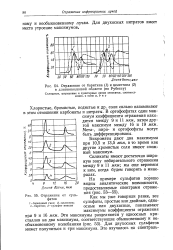 |
Отражение от баритина ( 1 и целестина ( 2 в длинноволновой области ( по Рубенсу.| Отражение от фатов. [18] |
Бихроматы дают два максимума при 10 5 и 13 5 мкм, в то время как другие хромистые соли имеют сложный максимум. [19]
Применяются бихроматы в текстильной промышленности при крашении тканей в ситцепечатании, в кожевенной промышленности, в спичечном производстве, в лабораториях как сильные окислители. [20]
Как твердые бихроматы, так и в особенности их подкисленные растворы во избежание восстановления следует тщательно предохранять от соприкосновения с органическими веществами ( в частности с фильтровальной бумагой); образующиеся при их восстановлении зеленые ионы трехвалентного хрома очень сильно снижают прозрачность растворов для желто-оранжевых излучений. Разбавление запасных растворов производят теми же жидкостями, которые использованы для растворения солей: аммиакат меди и хромат калия - 5 % - ным аммиаком, нитрит натрия - водой, остальные соли - 5 % - ными кислотами. [21]
ДИХРОМАТЫ, бихроматы, двухро-мовокислые соли - соли двухромовой к-ты Н2Сг2О7; сильные окислители. [22]
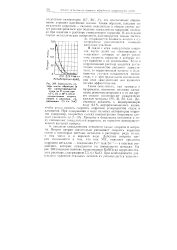 |
Зависимость потери массы образцов ( в мг малоуглеродистой стали за 21 сутки при 15 С ( 1 и 30 С ( 2 от концентрации нитрита натрия в растворе, содержащем 7 5 г / л NaCl. [23] |
Хроматы и бихроматы относятся к типу смешанных замедлителей коррозии, но тормозят преимущественной анодный процесс. [24]
Хроматы и бихроматы при сильном нагревании разлагаются с образованием Сг2О3 или хромитов. Известно много двойных хро-матов. Бихроматы К2Сг2О7 и Na2Cr2O7 - 2H2O являются исходными продуктами для получения различных соединений хрома. Как правило, бихроматы растворяются в воде лучше хроматов. Хроматы и бихроматы, обладают окислительной активностью. Они окисляют I, H2S, SOa, Fe2 и другие восстановители. Сильным окислителем является бихромат калия в кислой среде. [25]
Хроматы и бихроматы щелочных и некоторых других металлов хорошо растворимы. Хроматы тяжелых металлов, как правило, малорастворимы, что используют для осаждения и определения хрома. [26]
Хроматы и бихроматы обладают сильными окислительными свойствами, что часто используется в химических работах. Окисление производят в кислом растворе. Образующиеся ионы Сг 3 связываются с кислотными остатками прибавляемой кислоты и образуют соли трехвалентного хрома. [27]
Хроматы и бихроматы получают методом, который имеет широкое применение при получении солей из кислотных окислов-сплавлением со щелочными гидроокисями или карбонатами. В рассматриваемом случае карбонат калия предпочитают карбонату натрия, ввиду того что хромат и бихромат калия хорошо кристаллизуются из водных растворов и легко поддаются очистке путем перекристаллизации, в то время как соответствующие соли натрия расплываются и очищаются с трудом. [28]
Хроматы и бихроматы ( особенно в пылевидном состоянии) токсичны. При попадании на кожу и слизистые оболочки они вызывают местное раздражение, иногда с образованием язв. [29]
 |
Защитное действие К2Сг2О7 по отношению к стали в дистиллированной воде и в растворе NaCl ( при 30. [30] |
Страницы: 1 2 3 4