Бихроматы - калий
Cтраница 2
Наряду с этим ряд нейтральных солей, не изменяя кислотности среды, может оказывать замедляющее или ускоряющее действие на процесс коррозии. Для алюминия, в частности, хорошими пассиваторами являются хро-маты и бихроматы калия и натрия, а активаторами, как и для большинства металлов - соли галоидоводородных кислот. [16]
ОССБ готовят на буровой по следующей методике. Вначале ССБ смешивают с водой ( 1: 1), затем загружают хроматы или бихроматы калия или натрия, перемешивают 45 - 60 мин, вводят каустическую соду и добавляют остальную воду. Заготовленная ОССБ в соотношении 15: 35: 1: 1 ( ССБ - вода - хромпик - каустическая сода) должна выдерживаться в течение 8 - 12 ч перед введением в буровой раствор. [17]
Сульфат натрия перерабатывается в сернистый натрий и другие содержащие серу соли. В производстве красителей применяют сернистый натрий, нитрит натрия, хлорат калия, сульфат натрия, бихроматы калия и натрия и многие другие соли. Значительный ассортимент солей и окислов используется в качестве катализаторов при синтезе органических продуктов, для беспламенного горения и других процессов. [18]
Она тоже неустойчива и существует только в водных растворах. Гораздо более прочные соли ее называют бихроматами. Бихроматы калия К2Сг207 и натрия Na2Cr207 называют иначе хромпиками. [19]
Это процесс глубокого окисления, для которого применяются энергично действующие окислители и реакция проводится в жестких условиях. Окислителями для этого процесса служат чаще всего бихроматы калия или натрия, перманганат калия и азотная кислота различной концентрации. Бихроматы применяются для окисления в смеси с концентрированной серной кислотой. Такун смесь обычно называют хромовой смесью. [20]
Это легко наблюдать по изменению окраски раствора при изменении среды. Соли хромовой кислоты - хроматы окрашены обычно в желтый цвет, а бихроматы - в оранжевый. Из солей хромовых кислот наиболее важное практическое значение имеют бихроматы калия К2Сг207 и натрия Na Cr C, называемые в технике хромпиками. [21]
Здесь минеральные соли используются в качестве сырья для получения кислот, щелочей, газов и других солей, а также в качестве сырья и вспомогательных материалов для многих химических производств. Так, химическая промышленность потребляет колоссальные количества поваренной соли для получения хлора, соляной кислоты, едкого натра соды и других солей натрия и соединений хлора. Сульфат натрия перерабатывается в сернистый натрий и другие содержащие серу соли. В производстве красителей применяют сернистый натрий, нитрит натрия, хлорат калия, сульфат натрия, бихроматы калия и натрия и многие другие соли. Значительный ассортимент солей и окислов используется в качестве катализаторов при синтезе органических продуктов, для беспламенного горения и других процессов. [22]
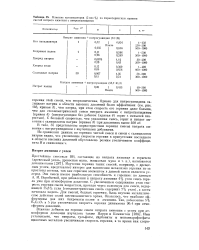 |
Влияние катализаторов ( 5 вес. % на характеристики горения смесей нитрата аммония с нитрогуанидином. [23] |
Изучение горения таких смесей, например, с древесным углем, представляет интерес для выяснения механизма горения из-за простоты состава, так как горючим элементом в данной смеси является углерод. Эти смеси имеют наибольшую способность к горению: по данным А. И. Воробьевой, при добавлении к нитрату аммония 4 % угля смесь горела уже при атмосферном давлении. С увеличением содержания угля скорость горения смеси возрастала, проходя через максимум для смеси, содержащей 15 8 % угля ( стехиометрическая смесь содержит 7 % угля), а затем начинала падать. Для смесей, бедных горючим, было изучено каталитическое действие солей шестивалентпого хрома. Оказалось, что наиболее эффективны для них бихроматы калия и аммония. [24]
Определение NO в газовой смеси проводят в помощью одного из описанных ПИП после предварительного окисления NO до NO2 в газовой, жидкой или твердой фазах подходящим окислителем. Для окисления оксида азота до диоксида в жидкой фазе могут быть использованы водные растворы окислителей: пероксид водорода, перманганат и бихромат калия или натрия, триоксид хрома, гипохлорит калия. Окисление оксида азота в водных растворах может протекать до диоксида азота или азотной кислоты в зависимости от концентрации окислителя и его стандартного окислительно-восстановительного потенциала. Достигнуть 100 % - ной степени окисления оксида азота до диоксида трудно вследствие частичного диспропорцио-нирования его с образованием HN02 и HNOs. В качестве окислителей оксида азота испытаны периодат, персульфат, перманганат и бихроматы калия и натрия, приготовленные в кислых и щелочных водных растворах в различных концентрациях и нанесенные на твердые носители. Наши исследования показали, что наилучшей окисляющей способностью обладает 50 % - ный раствор бихромата натрия в 10 % - ной H2SO4, нанесенный на диатомит. [25]
Страницы: 1 2