Термический анализ - система
Cтраница 2
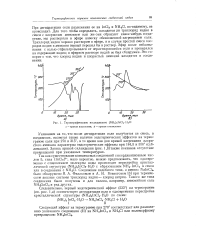 |
Термографическое исследование. [16] |
Соединение подобного типа, а именно NaInCl4, было обнаружено Я. А. Фиалковым и А. Н. Вовкогоном [3] при термическом анализе системы трихлорид индия - хлорид натрия. Такого же типа соединения были получены и для галлия, например, аммонийная соль NH4GaCl4 и ряд других. [17]
Я - Купфером была опубликована Заметка об удельном весе сплавов и их точке плавления [36], в которой он приводит данные термического анализа системы олово - свинец. [18]
Степановым) и сделал ряд предложений, на которые получены авторские свидетельства; часть этих предложений была освоена в промышленных условиях. В результате термического анализа системы фосфор-сера установлено, что в этой области существовали заблуждения относительно наличия ряда соединений. Исследование гидролитической способности сульфидов фосфора показало, что таковой обладают лишь высшие сульфиды. На основе физико-химического анализа разработаны условия синтеза различных сульфидов фосфора, стабильных при высоких п низких температурах. Изучены температура плавления и кристаллизации, а также вязкость фосфорно-серпых составов и исследованы некоторые термодинамические свойства сульфидов фосфора. Им проведен также ряд исследований в области хлоридов фосфора. [19]
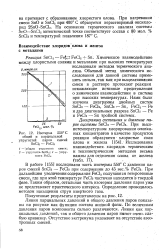 |
Изотерма 550 С. [20] |
При нагревании смеси SnO и SnCl2 при 400 С образуется нерастворимый оксихло-рид 2SnO - SnCla. На основании термического анализа системы SnO - SnCl2 эвтектической точке соответствует состав с 80 мол. [21]
Институтом горючих ископаемых Академии наук СССР был сконструирован фоторегистрирующий пирометр ФПК-55. Этот пирометр ( рис. 40, 41) предназначен для термического анализа систем или химических индивидуальных соединений. [22]
В некотрых случаях реакцию проводят при повышенной температуре. В этом отношении представляет интерес также ряд хлорофторидов, существование которых установлено термическим анализом системы SbCl5 - SbFB. Менее отчетливо при изучении диаграммы состояния заметны соединения SbCls 2SbF5, SbCl5 SbF5, SbCl3F3 и SbFs 2SbCl5, однако существование большинства из них подтверждается методом экстрагирования, а также выделением их в виде характерных кристаллов. Возможно, что в расплавленном состоянии находятся в равновесии все возможные комбинации. [23]
Оказалось, что кривые ликвидуса эвтектических диаграмм плавности описываются, уравнением Шредера в широких концентрационных пределах, вплоть до эвтектики. Применяя уравнение Шредера и используя данные термического анализа таких систем, можно определять молекулярный вес с большой точностью. Применение метода термического анализа систем для определения молекулярного веса позволяет значительно увеличить число веществ, пригодных к использованию в качестве растворителей при крносколическом определении молекулярного веса. [24]
Оба фторида легко растворяются в безводном фтористом водороде [ 501, образуя растворы, проводящие электрический ток. Фторид, цезия образует кислую соль CsF-HF ( T. Хотя результатов полного термического анализа системы CsF-HF в литературе не описано, однако почти точно известно о существовании еще одного кислого фторида, CsF - 2HF; не исключено, что существуют также высшие соединения. Фториды цезия и рубидия образуют двойные соли с бромидом и трихлоридом иода; ни один из других фторидов щелочных металлов с меньшим радиусом иона металла таких соединений не дает. [25]
При этом было установлено, что при образовании молекулярных соединений благородные газы имеют многочисленных аналогов среди летучих гидридов, а в случае гидратов также и среди веществ, молекулы которых составлены из многих атомов. Аналогия здесь, прежде всего, проявляется в сходстве условий образования и свойствах этих соединений и особенно в их изоморфизме. Для соединения сероводорода с фенолом по диаграммам плавкости иностранными учеными [2] была установлена формула H2S 2С НГ) ОН. Доказав изоморфное соосаждение благородных газов с соединением Н 5 с фенолом, Б. А. Никитин [3] вывел заключение о существовании аналогичных соединений благородных газов и приписал им такую же формулу. Однако термический анализ системы сероводород-фенол был проведен только по кривым ликвидуса и без учета количества сероводорода, оставшегося в газовой фазе. Применив специально разработанную методику для термического анализа систем, содержащих летучий компонент, Никитин, Ковальская и Пушлеп-ков [ г ] более точно определили диаграмму плавкости для этой системы и доказали, что соединению следует приписать формулу H2S ЗССНГ) ОН. [26]
При этом было установлено, что при образовании молекулярных соединений благородные газы имеют многочисленных аналогов среди летучих гидридов, а в случае гидратов также и среди веществ, молекулы которых составлены из многих атомов. Аналогия здесь, прежде всего, проявляется в сходстве условий образования и свойствах этих соединений и особенно в их изоморфизме. Для соединения сероводорода с фенолом по диаграммам плавкости иностранными учеными [2] была установлена формула H2S 2С НГ) ОН. Доказав изоморфное соосаждение благородных газов с соединением Н 5 с фенолом, Б. А. Никитин [3] вывел заключение о существовании аналогичных соединений благородных газов и приписал им такую же формулу. Однако термический анализ системы сероводород-фенол был проведен только по кривым ликвидуса и без учета количества сероводорода, оставшегося в газовой фазе. Применив специально разработанную методику для термического анализа систем, содержащих летучий компонент, Никитин, Ковальская и Пушлеп-ков [ г ] более точно определили диаграмму плавкости для этой системы и доказали, что соединению следует приписать формулу H2S ЗССНГ) ОН. [27]
Страницы: 1 2