Пентаборат
Cтраница 3
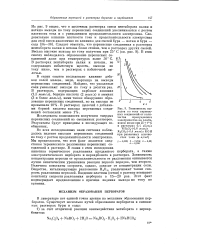 |
Зависимость выходов по току иерекис-ных соединений от количества пропущенного электричества на платиновом аноде при 25 1 С в растворах 0 4 моль / л. [31] |
Из рис. 9 видно, что в щелочных растворах смеси пентабората калия и поташа выходы по току перекисных соединений увеличиваются с ростом плотности тока и с уменьшением продолжительности электролиза. Следует отметить, что перекисные соединения в растворах пентабората калия и поташа более стойки, чем в растворах других смесей. [32]
Следовательно, часть маточного раствора должна выводиться из цикла. Этот способ заключается в переводе содержащегося в растворе тетрабората в более растворимый пентаборат натрия, в выпарке раствора и кристаллизации из него сульфата натрия; обедненный сульфатом раствор, содержащий В2О3 в форме пентабората, может быть возвращен в цикл. [33]
Образование небольших количеств диборана наблюдается при пропускании водорода над моноокисью бора ( В202) при - 1000 С. Так как моноокись бора получается при взаимодействии элементарного бора с борным ангидридом или пентаборатом натрия [92-94] в тех же условиях, то, очевидно, ее образование является первой стадией процесса получения диборана при пропускании водорода над смесью этих веществ. [34]
Например, из формулы ( 14) для 1 % - ного рас твора пентабората аммония гари L-20 и заданном райбросг тока 60 001 получим 100 мин, а для 60 01, t SE 10 мин. Результаты исследования отдельной поры и полученная формула ( 14) естественно могут быть распространены на объемно-пористое тело, пронизанное как цилиндрическими, так и любой другой формы порами, например извилистыми. [35]
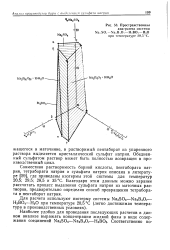 |
Пространственная диаграмма системы Na SOi-Na. BiO. - НзВОз - Н20. [36] |
Совместная растворимость борной кислоты, пентабората натрия, тетрабората натрия и сульфата натрия описана в литературе [59], где приведены изотермы этой системы для температур 20 5; 29 5; 28 5 и 35 С. Благодаря этим данным можно заранее рассчитать процесс выделения сульфата натрия из маточных растворов, предварительно определив способ превращения тетрабората в пентаборат натрия. [37]
Но, как известно, в таких условиях пербораты из реакционной смеси выделяются в виде вязкой массы, которая твердеет медленно, причем имеют место значительные потери активного кислорода. Наши опыты показали, что этого можно избежать, применяя для синтеза бораты с большим количеством бора, например, тетра - и пентабораты. Для этого указанные бораты при нагревании растворяют в избытке пергидроля и после охлаждения осаждают спиртом. [38]
При достаточно высокой концентрации сульфата натрия он может кристаллизоваться одновременно с бурой. С целью устранения этих недостатков незамкнутого процесса разработан ( 7 ] замкнутый технологический процесс с полным возвратом маточных растворов, основанный на данных о более высокой растворимости пентабората натрия Na2BioOi6 по сравнению с тетраборатом. [39]
Следовательно, часть маточного раствора должна выводиться из цикла. Этот способ заключается в переводе содержащегося в растворе тетрабората в более растворимый пентаборат натрия, в выпарке раствора и кристаллизации из него сульфата натрия; обедненный сульфатом раствор, содержащий В2О3 в форме пентабората, может быть возвращен в цикл. [40]
Ортоборная кислота и тетраборат натрия примени ются в стекольной и керамической промышленности; для пропитки древесины; в пищевой промышленности как консервирующее средство; в медицине. Тетраборат натрия применяется также при пайке и сварке металлов; в текстильной, мыловаренной, кожевенной, резиновой промышленности. Пентабораты калия и натрия, метабораты кальция, свинца и бария употребляют в производстве стекловолокна, глазури, эмали, резины, пластмасс; в текстильной промышленности; в производстве отбеливателей, добавок к стиральным порошкам; как добавки с целью снижения горючести материалов. Из сплавов боридов металлов с некоторыми переходными металлами изготовляют ответственные детали; ими борируют сталь и другие металлы, что повышает их твердость, износоустойчивость и коррозиен - ную стойкость; их применяют как катализаторы и как полупроводники. [41]
Пентаборат Cs20 - 5B203 существует в трех полиморфных модификациях. Последний переход происходит только при нагревании и должен рассматриваться как монотропный. Триборат и пентаборат могут образовать метастабильную эвтектику ( показана отдельно на рис. 170), содержащую 50.8 вес. Впервые полученный метаборат Cs2O - B203 легко образует длинные игольчатые кристаллы, относящиеся к кубической сингонии. Триборат характеризуется ромбической сингонией, тетраборат - псевдокубической. [42]
Линия АБ - растворимость пентабората натрия Na2Bi0Oi6 - 10H2O или Na2O - 5В2О3 10Н2О; растворимость тетрабората имеет минимум в точке В. Перевод тетрабората в пентаборат добавкой к раствору борной кислоты неприемлем, так как состав полученного раствора неблагоприятен для кристаллизации из него сульфата натрия. Этот перевод можно осуществить добавкой к раствору такого количества серной кислоты, которое требуется для нейтрализации Na2CO3 к перевода буры в пентаборат натрия; при этом содержание Na2SO4 в растворе увеличивается. [43]
Пожароопасные свойства: Негорючее взрывоопасное вещество, гигроскопично, на воздухе расплывается. Смеси с горючими веществами чрезвычайно опасны и могут самовозгораться или взрываться при незначительном повышении т-ры. Смешение хлората натрия с хлоридами, ацетатом натрия, содой не устраняет полностью опасности самовоспламенения; несколько менее опасны смеси с пентаборатом натрия. С водными растворами хлората натрия следует обращаться осторожно, так как препарат после высыхания на одежде, обуви может самовоспламеняться. Для предотвращения этого необходимо до окончания работы держать одежду влажной, после чего смыть хлорат большим количеством воды. [44]
Написание правильной формулы твердых соединений часто возможно только в тех случаях, когда известна их кристаллическая структура; в частности это относится к гидратам. В качестве других примеров пересмотра формул можно привести следующие: антимонаты [ Mn ( H3O) 6 ] [ Sb ( OH) 6 ] 2, которые раньше изображались в виде M ( SbO3), 12Н О, и пентаборат калия КН2В6О10 ( Н3О) 2, который раньше рассматривался как тетрагидрат КВ5О8 - 4Н О. Структура последнего соединения описана ниже как пример гидратированной кислой соли. Проблема строения кислых гидратов тесно связана с гидратацией ионов в водном растворе. В кристаллическом NiSO4 - 6H2O каждый ион Ni2 окружен шестью молекулами воды, а в BeS04 - 4H20 каждый ион Ве2 находится в центре тетраэдрической группы, состоящей из четырех молекул воды. В достаточно разбавленных растворах любой соли каждый ион полностью окружен молекулами воды, но не все ионы гидратированы в растворе. Считают, что ион гидратирован только в том случае, если молекулы воды, окружающие этот ион, определенным образом ориентированы относительно него. Расчет эффективного объема иона в растворе показывает, что все положительные ионы, за исключением самых больших одновалентных ионов ( например, Rb, Cs, NH4), гидратированы в растворе и что, например, ионы Ni2 и Ве2 в растворе имеют такое же окружение, как в вышеупомянутых гидратировгнных солях. Однако можно предположить, что в растворе ион Ni2 не окружен постоянно одними и теми же шестью - молекулами воды, как в кристаллическом гидрате. [45]
Страницы: 1 2 3 4