Большинство - атом
Cтраница 1
Большинство атомов и групп, связанных с углеродом, оказывают такого рода индуктивное влияние в том же направлении, что и атомы хлора; вследствие большей, по сравнению с атомами углерода, электроотрицательности они оттягивают от него электроны. Хотя в количественном отношении индуктивный эффект является довольно слабым, тем не менее он ответственен за возрастание основности, наблюдаемое при замещении атомов водорода в аммиаке на алкильную группу ( см. стр. Предложено несколько объяснений электроно-донорных свойств групп СНз, CH R, CHR2 и CRs, однако ни одно из них нельзя считать полностью убедительным и строгим. Этот вопрос до сих пор остается открытым. [1]
Большинство атомов d - и / - элементов образуют соединения с незавершенным строением этих подуровней. Такие соединения тоже парамагнитны, а элементарные ионы их и аквакомплексы в растворах указанных соединений обычно имеют окраску. [2]
Большинство атомов и ряд молекул обладают способностью присоединять электроны - обладают сродством к электрону. Величиной, характеризующей это сродство, является энергия связи электрона в образующемся отрицательно заряженном ионе. Из атомов наибольшим сродством к электрону порядка 3 5 эВ обладают атомы галогенов. [3]
Большинство атомов d - и f - элементов образует соединения с незавершенным строением этих подуровней. Такие соединения тоже парамагнитны, а элементарные ионы их и аквакомплексы в растворах указанных соединений обычно имеют окраску. [4]
Большинство атомов и групп, связанных с углеродом, оказывают такого рода индуктивное влияние в том же направлении, что и атомы хлора; вследствие большей, по сравнению с атомами углерода, электроотрицательности они оттягивают от него электроны. Хотя в количественном отношении индуктивный эффект является довольно слабым, тем не менее он ответственен за возрастание основности, наблюдаемое при замещении атомов водорода в аммиаке на алкильную группу ( см. стр. Предложено несколько объяснений электроно-донорных свойств групп СНз, CHaR, CHR2 и CRs, однако ни одно из них нельзя считать полностью убедительным и строгим. Этот вопрос до сих пор остается открытым. [5]
Большинство атомов обладает сложной зависимостью эффективного сечения от энергии, что, конечно, приводит к сложному выражению для дифференциальной испускательной способности. [6]
Большинство атомов газа в баллоне ионного прибора находится в нейтральном состоянии. Однако за счет внешних воздействий ( световых, рентгеновских, радиоактивных и других излучений) происходит ионизация не - Рис - 8л - Схема вклюа которых из них. [7]
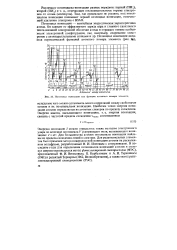 |
Потенциал ионизации как функция атомного номера элемента. [8] |
Для большинства атомов потенциалы ионизации найдены из предела схождения линий: в спектрах. Для редкоземельных элементов был применен метод поверхностной ионизации атомов на раскаленном вольфраме, разработанный П. И. Ионовым с сотрудниками. [9]
У большинства атомов первый ионизационный потенциал лежит в пределах от 5 до 10 в, что должно соответствовать образованию в процессе ионизации нового кулонов-ского поля па расстоянии примерно от 1 А до бесконечности. Электростатическая энергия кулоновского поля приблизительно равна 7 / г эв, если г измеряется в ангстремах. [10]
Для большинства атомов и тем более для более сложных частиц константа спин-орбитального взаимодействия находится экспериментально. [11]
 |
Схема возможного запол - билизирует систему. Последнее со. [12] |
Для большинства атомов ПИ измерены с высокой точностью спектроскопическим методом, основанным на определении предела схождения линий в атомных спектрах. [13]
Для большинства атомов рассматриваемых групп электронным конфигурациям ndk ( n - - 1) sz, ndk l ( л - f) s и ndk z соответствуют сравнительно близкие уровни энергии, причем порядок, в котором эти уровни расположены, различен для разных атомов. [14]
У большинства атомов элементов побочных подгрупп на внешней оболочке находится 2 электрона, у атомов Сг, Си, Nb, Mo, Ru, Rh, Ag, Pt, Аи - по 1-му электрону, а атом Pd - не имеет электронов на внешней s - подоболочке. [15]
Страницы: 1 2 3 4