Большинство - глобулярные белок
Cтраница 1
Большинство глобулярных белков находится в водно-солевой среде. Укладка элементов вторичной структуры при этом такова, что гидрофильные ( полярные, заряженные) аминокислотные остатки располагаются в осн. При этом глобула приобретает уникальную ( идентичную для всех молекул данного белка) компактную и стабильную форму. [1]
Большинство глобулярных белков кристаллизуется из раствора и может поэтому служить объектом для точного рентгено-структурного анализа. Ферменты являются глобулярными белками. [2]
У большинства глобулярных белков при нагревании или под воздействием экстремальных значений рН происходит развертывание цепей и утрата биологической активности без разрыва кова-лентных связей полипептидного остова. Многие годы процесс денатурации белков считался необратимым; например, белок, свернувшийся при варке яиц, после охлаждения уже не возвращается в исходное растворимое состояние. Однако было обнаружено, что у некоторых глобулярных белков, денатурированных путем нагревания или под воздействием экстремальных значений рН, нативная структура и биологическая активность восстанавливаются при медленном охлаждении раствора белка или медленном изменении его рН до нормального значения; такой процесс называется ренатура - - цией. [3]
В отличие от большинства глобулярных белков, фибриллярные белки функционируют не в растворе, но образуют надмолекулярные системы. Они обладают свойствами жидких кристаллов. [4]
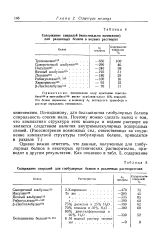 |
Содержание спиралей для глобулярных белков в различных растворителях. [5] |
По-видимому, для большинства глобулярных белков спиральность совсем мала. Поэтому можно сделать вывод о том, что компактная структура этих молекул в водном растворе не является следствием наличия внутримолекулярных водородных связей. [6]
Укажите вероятную причину того, что большинство глобулярных белков не содержит структур типа складчатой лепты. [7]
Укажите вероятную причину того, что большинство глобулярных белков не содержит структур типа складчатой ленты. [8]
Большинство глобулярных белков при кратковременном нагревании до 65 С денатурирует ( претерпевает процесс разворачивания цепей) с полной потерей активности. Однако те глобулярные белки, в которых содержится много остатков цистина, денатурируют только при более длительном нагревании до более высоких температур. Одним из таких белков является рибонуклеаза, содержащая 124 аминокислотных остатка в единственной полипептидной цепи, в которой имеется четыре поперечные дисульфидные связи, образованные остатками цистина. Чтобы полипептидная цепь рибонуклеазы развернулась, необходимо нагреть содержащий ее раствор до высокой температуры; если затем быстро охладить его, то ферментативная активность восстанавливается. [9]
Анализ, проведенный Тэнфордом [57] для большого числа белков, показал, что в большинстве случаев величина НА /, ответственная за гидрофобные взаимодействия, близка к величине T &. Этот факт означает, что для большинства глобулярных белков возможность существовать в свернутом ( нативном) состоянии обеспечивается почти целиком одними лишь гидрофобными взаимодействиями. [10]
Белки олигомерные - такие, функционально олигомерная молекула которых состоит более чем из одной полипептидной цепи. Обычно число полипептидных цепей в олигомерном белке кратно двум. Число цепей в олигомерном белке колеблется от двух до нескольких десятков. Большинство глобулярных белков о массой более чем 50000 являются олигомернымн. [11]
Уже давно известно, что некоторые ферменты имеют каталитически активные простетические группы. Активность этих ферментов, однако, также зависит от их белковых компонентов; об этом свидетельствует резкое падение их ферментативной активности при нагревании или под действием других факторов, ведущих к денатурации белка. Некоторые ферменты ( например, рибонуклеаза) относительно устойчивы к нагреванию. Поскольку большинство глобулярных белков легко денатурируется, термостабильность рибону-клеазы и некоторых других подобных ферментов указывает на то, что структура их белков более устойчива и жестка, чем структура обычных глобулярных белков. [12]
Два других метода будут описаны в разделе Г-5; они основаны на измерении эффекта Коттона в ультрафиолетовой области. Он применим, если можно определить предельные значения [ а ] для соответствующих конформаций идеальной спирали и статистического клубка. При длине волны D-линии натрия они составляют для водных растворов поли - Ь - глутаминовой кислоты приблизительно - j - 5 и - 110; аналогичные предельные значения можно определить и для других длин волн. Поскольку состав растворителя может влиять как на [ а1я, так и на Я, эти два метода применимы только тогда, когда среды, в которых существуют соответствующие конформаций, очень близки по составу; это требование обычно выполняется в случае водных растворов. Подобным образом, хотя большинство глобулярных белков укладывается на шкалу Яс, показанную на рис. 56, для некоторых белков не наблюдается заметного изменения Яс, а для других наблюдается фактически увеличение Яс при денатурации [ 39.1. Очевидно, что такие усложнения ограничивают применимость описанных выше двух методов. [13]
Он имеет слишком неопределенный характер, отражает неодинаковые, разнотипные изменения в белках и его целесообразнее заменять определением конкретных химических или физико-химических превращений, которые происходят в белковой молекуле. Принято считать, что денатурация представляет собой изменение макроструктуры белка - внутримолекулярную перегруппировку, переукладку структурных звеньев белковой частицы, связанную с изменением определенных свойств исходного нативного белка. По определению Козмана, денатурация - процесс ( или последовательность процессов), изменяющий пространственное расположение полипептидной цепи внутри молекулы белка от такого, которое характерно для нативного белка до более беспорядочного. Процесс этот совершается таким образом, что нативная структура разрушается, вероятно, сразу во всей молекуле или в большей ее части. Считают, что денатурационное превращение большинства глобулярных белков происходит, если не скачкообразно ( по принципу все или ничего), то во всяком случае проходя через небольшое число стадий. [14]
Страницы: 1