Большинство - реакция - восстановление
Cтраница 1
Большинство реакций восстановления протекает с большим выходом уже при комнатной температуре и атмосферном давлении и не дает побочных продуктов. В ряде случаев ли-тийорганические соединения эффективно применяются в процессах, в которых невозможно использовать магний-органические соединения. [1]
Большинство реакций восстановления проводят в сильнокислом растворе, чтобы избежать образования мешающего осадка и замедления реакции. Однако в известных случаях восстановление быстро протекает также и в сильнощелочном растворе, например восстановление Ag2O муравьиным альдегидом. [2]
Большинство реакций восстановления характеризуется присоединением водорода по кратной связи. Восстановление растворенными металлами, например натрием, может быть классифицировано как нуклеофильное присоединение; в соответствии с этим оно наблюдается для карбонильной группы, соединений с двойной связью С С, сопряженной с ароматическим ядром, и для многих азотсодержащих соединений, таких, как нитро -, нитрозо - и азосоединения. Этот второй тип восстановления и рассматривается в настоящей главе. Сюда включены также электролитическое восстановление и восстановление действием металлов и ионов металлов, которое может протекать с образованием радикалов. [3]
В большинстве реакций восстановления к кетону формально присоединяются два электрона и два протона и образуется вторичный спирт. Основными классами используемых реагентов являются водород в присутствии катализатора, комплексные гидриды металлов, растворенные металлы и вещества, переносящие водород. Реакции дезоксигенирования превращают кетоны в ал-каны или алкены. Одноэлектронное восстановление приводит к образованию анибн-радикалов, димеризация которых дает пина-коны ( 1 2-диолы, см. разд. Если карбонильная группа сопряжена с олефиновой двойной связью, восстановление может затрагивать одну, или другую, или обе группы. Электроотрицательные уходящие группы в а-положении к карбонильной функции в процессе восстановления часто замещаются водородом. [4]
В большинстве реакций восстановления к кетону формально присоединяются два электрона и два протона и образуется вторичный спирт. Основными классами используемых реагентов являются водород в присутствии катализатора, комплексные гидриды металлов, растворенные металлы и вещества, переносящие водород. Реакции дезоксигенирования превращают кетоны в ал-каны или алкены. Одноэлектронное восстановление приводит к образованию анион-радикалов, димеризация которых дает пина-коны ( 1 2-диолы, см. разд. Если карбонильная группа сопряжена с олефиновой двойной связью, восстановление может затрагивать одну, или другую, или обе группы. Электроотрицательные уходящие группы в а-положении к карбонильной функции в процессе восстановления часто замещаются водородом. [5]
Такой простой схемой удается объяснить большинство реакций восстановления. В действительности же картина является более сложной, так как гидрид-эквиваленты, представляемые как / 4 LiAlH4 или / 4 NaBH4, не существуют как таковые. Комплексные гидриды металлов этого типа реагируют с карбонильными соединениями в четыре, следующие одна за другой стадии с образованием соответствующих тетраалкоксипроизводных. При восстановлении боргидридом натрия скорость процесса определяет первая стадия. [6]
Несомненно, здесь имеется возможность совершенно различных механизмов в противоположность общему характеру механизмов реакций присоединения к карбонильной группе, в особенности механизмов большинства реакций восстановления под действием гидридов. По этой причине, а также на основании других соображений ( разд. [7]
 |
Результаты гидрирования коричной кислоты. [8] |
Для гидрирования соединений ароматического ряда пользуются ледяной уксусной кислотой в качестве растворителя и диоксидом платины как катализатором. Большинство реакций восстановления можно проводить в 95 % - ном этаноле над 10 % - ным палладием на угле. Количество катализатора обычно должно составлять 10 - 20 % ( масс.) пробы. [9]
 |
Восстановительная способность некоторых гидридов бора. [10] |
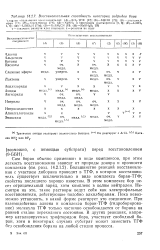
Сам боран обычно применяют в виде комплексов, при этом легкость восстановления зависит от природы донора и прочности комплекса ( см. разд. Большинство реакций восстановления с участием диборава проводят в ТГФ, в котором восстановитель существует исключительно в виде комплекса боран - ТГФ; свойства последнего хорошо известны. В этом комплексе бор несет отрицательный заряд, хотя комплекс в целом нейтрален. Несмотря на это, такие растворы ведут себя как электрофильные восстановители, действующие подобно алкилборанам. Пока невозможно установить, в какой форме реагирует это соединение. При взаимодействии алкена и комплекса боран - ТГФ ( гидроборирова-ние) молекула ТГФ только частично освобождается от борана на ранней стадии переходного состояния. В других реакциях, например катализируемых трифторидом бора, участвует свободный боран, хотя в некоторых случаях субстрат может заместить ТГФ без освобождения борана на любой стадии процесса. [11]
 |
Восстановительная способность некоторых гидридов бора. [12] |
Сам боран обычно применяют в виде комплексов, при этом легкость восстановления зависит от природы донора и прочности комплекса ( см. разд. Большинство реакций восстановления с участием диборана проводят в ТГФ, в котором восстановитель существует исключительно в виде комплекса боран - ТГФ; свойства последнего хорошо известны. В этом комплексе бор несет отрицательный заряд, хотя комплекс в целом нейтрален. Несмотря на это, такие растворы ведут себя как электрофильные восстановители, действующие подобно алкилборанам. Пока невозможно установить, в какой форме реагирует это соединение. При взаимодействии алкена и комплекса боран - ТГФ ( гидроборирова-ние) молекула ТГФ только частично освобождается от борана на ранней стадии переходного состояния. В других реакциях, например катализируемых трифторидом бора, участвует свободный боран, хотя в некоторых случаях субстрат может заместить ТГФ без освобождения борана на любой стадии процесса. [13]
Приведенное уравнение является лишь частным случаем восстановления с помощью молекулярного водорода ( в каталитических реакциях) или водорода в момент выделения. В большинстве реакций восстановления нитросоединений водород в реакционную среду не вводится, поэтому в общем виде процесс правильнее представлять как систему реакций, в которых принимают участие нитросоедине-ние, играющее роль окислителя, и вещества, являющиеся восстановителями. Следовательно, восстановление нитросоединений следует рассматривать как частный случай окислительно-восстановительной реакции. В качестве восстановителя обычно применяют железо. [14]
Восстановление карбонильных соединений происходит по типу реакции бимолекулярного нуклеофильного присоединения Adx, в которой катион М играет роль катализатора. Такой простой схемой удается объяснить большинство реакций восстановления, хотя в действительности процесс является гораздо более сложным. Большое значение в реакциях восстановления имеет растворитель. Реакции с участием алюмогидрида лития легко идут лишь в растворителях, обладающих донорными свойствами, например в эфирах. [15]
Страницы: 1 2