Большинство - случай - коррозия
Cтраница 1
Большинство случаев коррозии при трении, встречающихся на практике, по-видимому, можно разделить на два различных класса в зависимости от того, должны или нет поверхности деталей перемещаться относительно друг друга. Если поверхности не должны перемещаться, то прежде всего необходимо предотвратить возможность скольжения, исключив источник вибрации или увеличив трение между поверхностями. Полагают, что положительное влияние гальванических покрытий на понижение фреттинг-коррозии некоторых мягких металлов связано с улучшением сопряжения деталей и, следовательно, повышенным трением между ними. [1]
В большинстве случаев коррозии подвергается вся поверхность или ее отдельные части, при этом не образуются какие-либо слои или отложения. Это имеет место в слабокислых растворах солей, в кислотах или в комплексообразующих растворах полифосфатов, а также в тех случаях, когда коррозионная среда может беспрепятственно и без завихрений поступать к поверхности корродирующего металла. [2]
 |
Схема катодного процесса водородной деполяризации. [3] |
В большинстве случаев коррозии металлов с водородной деполяризацией при высокой концентрации ионов Н Н2О в растворе концентрационная поляризация вследствие замедленности переноса водородных ионов к катодным участкам незначительна. Это обусловлено большой подвижностью водородных ионов, наличием дополнительного перемешивания раствора у катода выделяющимся газообразным водородом и дополнительным переносом водородных ионов к катоду миграцией. В нейтральных растворах или при очень больших скоростях коррозии ионная концентрационная поляризация становится заметной. [4]
Для того чтобы понять механизм действия замедлителей, рассмотрим сущность электрохимической коррозии, которая дает объяснение большинства случаев коррозии. [5]
Из различных теорий, объясняющих коррозионные процессы, в настоящее время наиболее широким признанием пользуется злектрохимическая, которая дает удовлетворительное объяснение большинства случаев коррозии. [6]
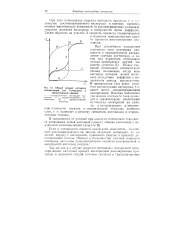 |
Общая кривая катодной. [7] |
Если в электролите имеется какой-либо окислитель, способный восстанавливаться на данном катодном материале, то он может, наряду с кислородом, принимать участие в процессе деполяризации катода. Обычно в большинстве случаев коррозии основным катодным деполяризатором является растворенный в электролите кислород воздуха. [8]
Угольная кислота в процессе коррозии с кислородной и водородной деполяризацией не нейтрализуется, содержание ее остается почти неизменным, и кислородная коррозия стали не уменьшается со временем. Несмотря на то что коррозия с выделением водорода составляет всего лишь 2 5 - 4 % общей скорости разрушения, большинство случаев коррозии стального оборудования обусловлено ею, так как в присутствии угольной кислоты создаются условия, благоприятствующие протеканию кислородной коррозии. [9]
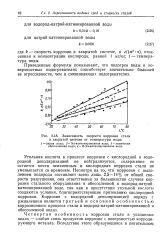 |
Зависимость скорости коррозии стали. [10] |
Угольная кислота в процессе коррозии с кислородной и водородной деполяризацией не нейтрализуется, содержание ее остается почти неизменным и кислородная коррозия стали не уменьшается со временем. Несмотря на то, что коррозия с выделением водорода составляет всего лишь 2 5 - 14 % от общей скорости разрушения, она ответственна за большинство случаев коррозии стального оборудования в обессоленной и водород-натрий-катионированной воде, так как в присутствии угольной кислоты создаются условия, благоприятствующие протеканию кислородной коррозии. Коррозия с водородной деполяризацией наряду с ржавлением является т р етье и и основной особенностью коррозионного процесса стали в водород-натрий-катионированной и обессоленной водах. [11]
В; пара: М недеформированный - М деформированный) ]; 4) различные части металла находятся в неодинаковых физико-химическ х условиях напр. Особенно важным случаем такого рода концентрационных пар являются гальванич. В большинстве случаев коррозии различные типы гальванических пар имеют место одновременно. [12]
Обычно перенапряжение ионизации металла при растворении металлов в активном состоянии имеет низкие значения. Поэтому торможение анодного процесса в большинстве случаев коррозии также относительно невелико. Механизм и современная теория пассивности рассмотрены в следующей главе. [13]
Страницы: 1