Большинство - соединение - углерод
Cтраница 1
Большинство соединений углерода, прежде всего углеводороды и их производные, обладают ярко выраженным характером гомеополярных соединений. [1]
 |
Электронное строение атома углерода и образование ионов. [2] |
Большинство соединений углерода относится к группе так называемых органических соединений. Название органические соединения имеет теперь только историческое значение. Они считали, что эти соединения можно выделять, очищать, но получать их искусственно нельзя, так как для их синтеза требуется якобы особая жизненная сила. Такое ложное мнение возникло потому, что эти вещества имеют сложный химический состав и их не умели получать искусственным путем. [3]
Большинство соединений углерода, прежде всего углеводороды и их производные, обладают ярко выраженным характером гомеополярных соединений. [4]
Большинство соединений углерода имеют большое практическое значение: нефть, пластмассы, каучук, синтетические и искусственные волокна, красители, органические соединения, применяемые в сельском хозяйстве ( инсектициды, фунгициды, гербициды, ростовые вещества), медицинские препараты, витамины и ферменты и другие. [5]
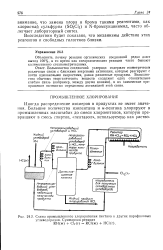 |
Схема промышленного хлорирования пентапа и других парафиновых углеводородов. Суммарная реакция. [6] |
Большинство соединений углерода содержит геометрически различные связи с близкими энергиями активации, которые реагируют с почти одинаковыми скоростями, давая различные продукты. Большинство обычных неорганических веществ содержит одну относительно слабую связь ( например, между двумя ионами), и их химические превращения полностью определены активацией этой связи. [7]
Большинство соединений углерода относится к группе так называемых органических соединений. [8]
Следует добавить, что большинство соединений углерода конденсируется в молекулярные жидкости и твердые вещества. Их температуры плавления в большинстве случаев низкие ( ниже 300 С), причем многие соединения углерода кипят ниже 100 С. Сходство химических свойств жидкой и твердой фаз показывает идентичность молекул в них. [9]
Обычно из числа соединений углерода к органическим веществам причисляют те, которые по своему составу, строению и свойствам являются жизненно важными углерод-содержащими соединениями. Это справедливо для большинства соединений углерода. [10]
Обычно из числа соединений углерода к органическим веществам причисляют те, которые по своему составу, строению и свойствам являются жизненно важными углерод-содержащими соединениями. Это справедливо для большинства соединений углерода. Однако существует значительное число углеродсодержащих соединений, которые построены совсем иначе и имеют другой состав по сравнению с упомянутыми выше веществами, от которых они поэтому существенно отличаются своими свойствами. Примером могут служить карбиды металлов. [11]
Органической химией называют науку о соединениях углерода. Соединения углерода обладают некоторыми специфическими свойствами, которые отличают их от неорганических веществ: почти все органические соединения горят, при незначительных внешних воздействиях сильно изменяют свои свойства или разлагаются, углерод в органических веществах соединяется почти со всеми элементами периодической системы, большинство соединений углерода не диссоциирует на ионы, поэтому реакции с органическими веществами протекают медленно. Органические вещества имеют исключительно большое значение в природе: из них состоят все живые организмы. [12]
В основу новой научной системы органической химии Шорлеммер положил развитое им учение об углеводородах. Углеводороды, - писал он, - суть не только наиболее простые углеродистые соединения; с теоретической точки зрения они также наиболее важные, потому что все другие соединения углерода получаются из углеводородов путем подстановки других элементов на место водорода... Следовательно, большинство соединений углерода содержит водород или углеводородный остаток, от которого эти соединения теоретически производятся. [13]
В заполненной валентной оболочке электроны занимают все доступное пространство вокруг центрального остова. В рамках простой модели жестких сфер это означает, что вокруг центрального остова образуется плотная упаковка сфер, моделирующих электронные облака, и координация дополнительных сфер невозможна. Для незаполненных валентных оболочек в рамках той же модели возникает следующая картина: после расположения всех сфер на валентной оболочке еще остается свободное пространство, достаточное для одной или более дополнительных электронных пар. Поскольку сферы не касаются друг друга, не существует силы, противодействующей уменьшению валентных углов между электронными парами, до тех пор, пока сферические орбитали не коснутся друг друга. В этом случае электронная плотность, особенно в пространстве между электронными парами, будет ничтожно малой, так что взаимодействие электронных пар окажется очень слабым. Поэтому такие электронные пары могут сравнительно легко сближаться до достижения некоторого критического положения, после чего начинается резкое увеличение отталкивания между электронными облаками, которое препятствует их дальнейшему сближению. В большинстве соединений углерода, азота, кислорода и фтора их валентная оболочка полностью заполнена четырьмя электронными парами. Эти четыре электронные пары расположены тетраэдрически и занимают все доступное пространство вокруг центрального остова, поэтому искажение такой структуры затруднено. [14]
Страницы: 1