Большинство - интерметаллическое соединение
Cтраница 1
Большинство интерметаллических соединений весьма тверды и тугоплавки, незначительно изменяются на воздухе, некоторые из них - полупроводниковые материалы. Литиевые лигатуры ( кремний - литий, алюминий - литий, железо - кремний - литий) и литийкальциевые сплавы ( 30 % Li, 70 % Са) служат присадками к углеродистым, хромистым, аустенитным хромоникелевым и др. сталям, а также модификаторами литой малолегированной быстрорежущей стали. В этом случае используют хорошее раскисляющее действие лития, его способность повышать жидкотекучесть, мех. [1]
Большинство интерметаллических соединений титана, циркония и гафния нацело разлагаются при плавлении, и только некоторые из них остаются частично неразложенными. [2]
Однако для большинства интерметаллических соединений, в особенности для d - элементов, закономерности более сложны и теоретически предсказать изложенным способом их состав и структуру пока невозможно. [3]
Элементы-металлы и большинство интерметаллических соединений характеризуются высокой степенью делокализации электронов, занимающих орбитали кристалла. Во многих случаях электроны остаются еще делокализованными, когда вещество находится в жидком состоянии, но для газообразного состояния это невозможно. Чем больше отличаются элементы, входящие в состав соединения, по относительной электроотрицательности, тем более ионный характер имеет это соединение, тем более локализованы его электроны. Металлы в низких степенях окисления находятся в своих соединениях обычно в виде ионов, и заряд на таких положительных попах часто равен степени окисления элемента. Так, все элементы группы IA в соединениях с неметаллами имеют степень окисления 1 и существуют в виде ионов с зарядом 1 в кристаллическом и жидком состояниях этих соединений. Точно так же для элементов группы ПА известна только степень окисления 2 и во всех своих термодинамически устойчивых при комнатной температуре соединениях эти элементы существуют в виде положительных двузарядных ионов. [4]
Элементы-металлы и большинство интерметаллических соединений характеризуются высокой степенью делокализации электронов, занимающих орбптали кристалла. Во многих случаях электроны остаются еще делокализованными, когда вещество находится в жидком состоянии, но для газообразного состояния это невозможно. Чем больше отличаются элементы, входящие в состав соединения, по относительной электроотрицательности, тем более ионный характер имеет это соединение, тем более локализованы его электроны. Металлы в низких степенях окисления находятся в своих соединениях обычно в виде ионов, и заряд на таких положительных нонах часто равен степени окисления элемента. Так, все элементы группы IA в соединениях с неметаллами имеют степень окисления 1 и существуют в виде ионов с зарядом 1 в кристаллическом и жидком состояниях этих соединений. Точно так же для элементов группы ПА известна только степень окисления 2 и во всех своих термодинамически устойчивых при комнатной температуре соединениях эти элементы существуют в виде положительных двузарядных ионов. [5]
Необычный состав большинства интерметаллических соединений определяется не только делокализацией электронов, но и наличием анион-анионных и катион-катионных связей, в то время как в солеобразных соединениях, отвечающих правилу формальной валентности, существуют только катион-анионные связи. Соединения Курнакова в структурном отношении не отличаются от компонентов и лишь упорядочение придает им качественную особенность. [6]
Однако в большинстве интерметаллических соединений, в особенности d - элементов, закономерности оказываются более сложными, поэтому теоретически предсказать состав и структуру большинства интерметаллидов изложенным способом пока невозможно. [7]
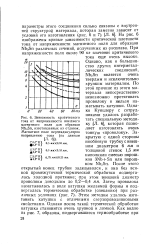 |
Зависимость критического тока от напряженности внешнего магнитного поля для образцов Nb3Sn, изготовленных из отливок. Магнитное поле перпендикулярно направлению тока ( по данным. [8] |
Однако, как и большинство других интерметаллических соединений, Nb3Sn является очень твердым и исключительно хрупким материалом. По этой причине из этого материала непосредственно невозможно протягивать проволоку и нельзя наматывать катушки. [9]
В настоящее время структуры всех важнейших металлов и большинства интерметаллических соединений определены. [10]
В предыдущих разделах мы подробно рассмотрели экспериментальные данные, полученные для большинства интерметаллических соединений РЗЭ с немагнитными металлами. Основная часть имеющихся сведений связана главным образом с кристаллографическими и магнитостатическими свойствами различных систем; однако в последнее время эффект Мессбауэра стал поставлять большую долю информации, которая в конечном счете должна приниматься во внимание при интерпретации других свойств. [11]
Другой особенностью металлов является то, что обычные представления о валентности элементов не способны объяснить химический состав большинства интерметаллических соединений. Состав интерметаллических фаз часто не подчиняется закону простых кратных отношений и может варьировать в широких пределах. Этот факт говорит о том, что металлическая связь не ограничивает соотношение атомов элементов ни численно, ни пространственно. Каждый атом в металле стремится окружить себя максимальным ( Количеством соседних атомов. Последнее подтверждается тем, что структуры металлов обычно удовлетворяют требованиям, вытекающим из теории плотнейших упаковок, и характеризуются большими координационными числами. [12]
 |
Схема различных случаев распределения двух типов атомов в кристалле. [13] |
Случай В характеризуется не только ближним порядком, в нем наблюдается и дальний порядок. Большинство интерметаллических соединений характеризуется именно такой степенью упорядоченности, причем ее часто выражают определенным процентом от идеальной упорядоченности. [14]
 |
Типы диаграмм состояния с непрерывными твердыми. [15] |
Страницы: 1 2