Задача - расчет - равновесие
Cтраница 1
Задача расчета равновесия может быть сформулирована следующим образом: по заданным исходному составу газовой смеси и температуре необходимо определить равновесную степень превращения или равновесный состав. [1]
Задача расчета равновесия на этом не заканчивается. [2]
В принципе задача расчета равновесия жидкость - пар для любой смеси легких углеводородов может быть решена с помощью этих уравнений. На практике, однако, использование их для расчета точек росы, давления насыщения или составов сосуществующих фаз сопряжено с трудоемким расчетом систем степенных, нелинейных уравнений методом последовательных приближений. [3]
В формулировке задачи расчета равновесия должны также указываться условия, при которых в равновесной системе реализуется экстремум ее характеристической функции. Согласно рассмотренным ранее критериям равновесия эти условия - постоянство всех естественных аргументов характеристической функции системы. Поскольку в итоге расчета через эти аргументы выражаются искомые дополнительные внутренние переменные, они должны быть величинами не только постоянными, но и известными. [4]
Известно, что задача расчета равновесия твердого тела, лежащего на гладкой горизонтальной поверхности, становится статически неопределенной, когда число точек опоры превышает три. Поэтому, чтобы найти распределение опорных реакций, приходится прибегать к дополнительному предположению об упругости основания. [5]
Вывод соотношений (14.13) - (14.18) еще нельзя считать решением задачи расчета равновесия, поскольку в общей формулировке такая задача требует выражения внутренних свойств системы через ее независимые переменные. [6]
При равновесии прекратятся изменения трех перечисленных величин и они примут строго определенные значения при данной температуре. Задача расчета равновесия применительно к этому случаю состоит в нахождении такого состава газовой фазы, при котором будет достигнута желаемая концентрация углерода в железе. [7]
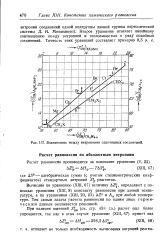 |
Взаимосвязь между энтропиями однотипных соединений. [8] |
Вычислив по уравнению ( XIII, 67) величину AZ, определяют с помощью уравнения ( XIII, 8) константу равновесия при данной температуре, а по уравнениям ( XIII, 20, 21) AZ и Да при любой температуре. Тем самым задача расчета равновесия по одним лишь термическим данным оказывается решенной. [9]
Определение коэффициентов эмпирических зависимостей является широко распространенной задачей в практике обработки экспериментальных данных. Поэтому при отсутствии аналитической зависимости К К ( Т) задача расчета равновесия разбивается на две независимые части. В общей постановке ( произвольное число компонентов исходной смеси, произвольная степень аппроксимирующего полинома) программа не размещается на наборном поле машины. [10]
В химической промышленности большое распространение имеют системы, включающие две жидкие фазы. При моделировании процессов экстракционного и ректификационного разделения таких смесей стоит задача расчета равновесий жидкость-жидкость и жидкость-жидкость-пар. [11]
Определение коэффициентов эмпирических зависимостей является широко распространенной задачей в практике обработки экспериментальных данных. Поэтому при отсутствии аналитической зависимости К К - ( Т) задача расчета равновесия разбивается на две независимые части. В общей постановке ( произвольное число компонентов исходной смеси, произвольная степень аппроксимирующего полинома) программа не размещается на наборном поле машины. [12]
Соответствующие модели также делятся на детерминистские и эмпирические. Простейший вид первых - равновесные: предполагается, что химический объект находится во внутреннем равновесии и все возможные реакции между интересующими аналитика компонентами известны. В таком случае математической моделью служит просто совокупность уравнений закона действующих масс для каждой реакции и система уравнений материального баланса. В неорганическом анализе речь чаще всего идет о реакциях комплексообразования. Известны ( измерены), как правило, общие, аналитические концентрации ряда компонентов, нужно же найти их равновесные концентрации, а также равновесные концентрации продуктов всевозможных реакций. С математической точки зрения эта, так называемая прямая задача расчета равновесия сводится к решению системы нелинейных уравнений ( материального баланса), стандартной в вычислительном отношении процедуре. Отметим лишь два распространенных алгоритма: метод Ньютона - Рафсона и метод Гинзбурга. Заметим также, что вычисления требуют знания констант равновесия возможных реакций. Нередко они отсутствуют в литературе; тогда аналитикам приходится определять их по экспериментальным данным. Это обратная задача расчета равновесий, основу математического аппарата здесь составляет нелинейный МНК. [13]
Химическое и фазовое равновесия должны быть вычислены одновременно с учетом их сильного взаимодействия. Решение этой проблемы в общем виде пока не найдено. При рассмотрении проблемы многокомпонентной экстракции, как правило, проводят аналогию с многокомпонентной ректификацией. Однако если в ректификации часто допускают при расчете равновесия жидкость - пар одну из фаз ( паровую) идеальной, то при многокомпонентной экстракции этого допущения принять нельзя из-за нарушения адекватности модели. Отличие расчета многокомпонентного равновесия жидкость - жидкость от такого же в системе жидкость - пар состоит также в том, что в системе жидкость - жидкость задача решается при заданной температуре, а коэффициенты распределения существенно зависят от концентраций всех компонентов в обеих фазах. При расчете равновесия жидкость - пар коэффициенты распределения, как правило, сильно зависят от состава только одной жидкой фазы, и если этот состав задан, то итерации осуществляются только по температуре, что значительно облегчает решение задачи расчета равновесия. Температура и точка ввода литания являются теми степенями свободы в ректификации, с помощью которых достигается необходимая степень разделения. [14]
Страницы: 1