Большинство - галогенид - щелочной металл
Cтраница 1
Большинство галогенидов щелочных металлов кристаллизуется в решетке каменной соли - хорошо известной структуре из двух взаимно проникающих кубических гранецентрированных решеток из катионов и анионов. Такую структуру имеют фториды, хлориды, бромиды и иодиды лития, натрия, калия и рубидия. Соли цезия, как правило, имеют другую структуру, хотя CsF, так же как и CsCl при повышенных температурах, кристаллизуется в структуре каменной соли. Ион цезия - самый большой катион этой группы - может иметь координационное число больше шести, как в структуре каменной соли. [1]
Второй механизм из-за присутствия Хм ( атом галогена имеет больше электронов, чем замещаемый им атом металла) привел бы к проводимости я-типа, чего, однако, не наблюдается. Более того, в большинстве галогенидов щелочных металлов пространственные затруднения не позволяют атомам галогена размещаться в узлах металла. Следовательно, от второй модели можно смело отказаться. [2]
 |
Гранецеятрироваяяая кубическая решетка ( плотнейшая кубическая упаковка.| Галогениды щелочных металлов, принадлежащие к типу каменной соли. [3] |
По типу каменной соли построено большинство галогенидов щелочных металлов. Следует отметить, что-гидриды щелочных металлов обладают таким же типом строения ( см. стр. [4]
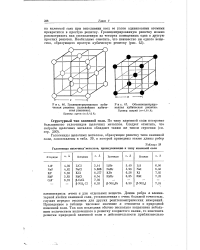 |
Гранецентрированная кубическая решетка ( плотнейшая кубическая упаковка.| Галогениды щелочных металлов, принадлежащие к типу каменной соли. [5] |
По типу каменной соли построено большинство галогенидов щелочных металлов. Следует отметить, что гидриды щелочных металлов обладают таким же типом строения ( см. стр. [6]
При этом если выбор значения т - 6 является в какой-то мере обоснованным ( если иметь в виду лондоновские диполь-дипольные дисперсионные силы), то значение п 12 взято совершенно произвольно. Было показано, что параметр р почти не меняется для большинства галогенидов щелочных металлов и составляет приближенно 0 35 А. Позднее Блейк и Майер [3] подтвердили преимущества использования экспоненциального закона перед степенным. Они вычислили по методу Гайтлера - Лондона отталкивание между двумя атомами с заполненными оболочками ( с восемью электронами) и установили, что во всем интервале межатомных расстояний от 1 8 А до 3 1 А экспоненциальная функция приводит к лучшему соответствию с экспериментом. Однако значение р, вычисленное этими авторами, оказалось несколько меньшим ( на 0 2 А), чем это следовало из экспериментов по сжимаемости кристаллов галогенидов щелочных металлов. [7]
При этом если выбор значения т 6 является в какой-то мере обоснованным ( если иметь в виду лондоновские диполь-дипольные дисперсионные силы), то значение п 12 взято совершенно произвольно. Было показано, что параметр р почти не меняется для большинства галогенидов щелочных металлов и составляет приближенно 0 35 А. Позднее Блейк и Майер [3] подтвердили преимущества использования экспоненциального закона перед степенным. Они вычислили по методу Гайтлера - Лондона отталкивание между двумя атомами с заполненными оболочками ( с восемью электронами) и установили, что во всем интервале межатомных расстояний от 1 8 А до 3 1 А экспоненциальная функция приводит к лучшему соответствию с экспериментом. Однако значение р, вычисленное этими авторами, оказалось несколько меньшим ( на 0 2 А), чем это следовало из экспериментов по сжимаемости кристаллов галогенидов щелочных металлов. [8]
Титанат бария обладает сегнето-электрическими свойствами в широком диапазоне температур и в этом отношении имеет ряд преимуществ перед другими сегнето-электриками. Монокристаллы титаната бария могут быть получены из расплавленных систем титаната бария и фторидов, хлоридов, сульфатов, силикатов, карбонатов и других соединений щелочных металлов; титанат бария плохо растворим в расплавах большинства галогенидов щелочных металлов, за. [9]
По расчетам Борна и Мейера, при нормальных давлении и температуре кристаллы всех галогенидов щелочных металлов должны иметь структуру типа NaCl. Катионы и анионы образуют две вставленные друг в друга гранецентрированные кубические решетки. Давно известно, что большинство галогенидов щелочных металлов действительно образуют кристаллы типа NaCl. Но в ряду Na, К, Rb, Cs кристаллическая решетка типа NaCl постепенно теряет устойчивость. Хлористый, бромистый и йодистый цезий кристаллизуются в решетке типа CsCl. Катионы и анионы располагаются в узлах двух вставленных друг в друга простых кубических решеток. [10]
Затем пропускают ток и измеряют толщину электродов и пластинок кристалла. Если двигался только отрицательный ион, то пластинка, расположенная ближе к аноду, будет толще другой, так как отрицательные ионы соединяются с металлом анода. Если двигались только ионы металла, то толщина пластинок кристалла не изменится, а металл будет перенесен от катода к аноду. Опыты такого рода показывают, что отрицательные ионы подвижны только в ВаС12, РЬС12 и РЬВг2; положительные ионы - только в AgCl, AgBr, Agl, a - CuBr, a - Cul и в большинстве галогенидов щелочных металлов ниже 500 С, а оба типа ионов - только в РЫ2 и галогенидах щелочных металлов при высоких температурах. Высокотемпературные формы Agl и Ag2HgI4 характеризуются ненормально высокой ионной электропроводностью, о которой будет сказано ниже. [11]
Страницы: 1