Переход - молекула - вещество
Cтраница 1
Переход молекул вещества из подвижной фазы в неподвижную и обратно за счет диффузии ничем не затруднен. Иная ситуация складывается внутри гранул. Здесь диффузия более или менее затруднена из-за столкновений молекул диффундирующего вещества с нитями пространственной сетки полимера или стенками пор. Если размеры молекул соизмеримы со средним диаметром каналов в гранулах, то эти затруднения становятся весьма существенными и диффузия тормозится. [1]
Диффузией называется переход молекул вещества из области с более высокой его концентрацией в область с более низкой концентрацией. Закономерности диффузии описываются законами Фика. [2]
Для получения спектра поглощения вещество не нужно вводить в источник света, где оно может быть разрушено под действием высокой температуры. Полосы в спектре соответствуют переходу молекул вещества с нижних уровней, на которых они находятся в обычных условиях, в возбужденное состояние. Поэтому в отличие от эмиссионных спектров спектры поглощения определяются молекулярным строением вещества и абсорбционный анализ является, главным образом, молекулярным анализом. [3]
Для получения молекулярного спектра поглощения вещество не нужно вводить в источник света, где оно может быть разрушено под действием высокой температуры. Полосы в спектре соответствуют переходу молекул вещества с нижних уровней, на которых они находятся в обычных условиях, в возбужденное состояние. Поэтому в отличие от эмиссионных спектров спектры поглощения определяются молекулярным строением вещества и абсорбционный анализ является, главным образом, молекулярным анализом. [4]
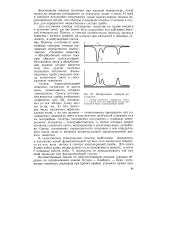 |
Изображение спектров поглощения. [5] |
Для получения спектра поглощения вещество не нужно вводить в источник света, где оно может быть разрушено под действием высокой температуры. Полосы в спектре соответствуют переходу молекул вещества с нижних уровней, на которых они находятся в обычных условиях, в возбужденное состояние. Поэтому в отличие от эмиссионных спектров спектры поглощения определяются молекулярным строением вещества, и абсорбционный анализ главным образом молекулярный. Источником света в абсорбционном анализе служит нагретое тело или другой источник сплошного излучения. Анализируемую пробу помещают между источником света и спектральным аппаратом. [6]
Термодинамическая характеристика поверхности раздела двух фаз, определяемая работой обратимого изотермического образования единицы площади этой поверхности, называется поверхностным натяжением и измеряется в Дж / м или Н / м, В случае жидкой поверхности раздела поверхностное натяжение можно рассматривать также как силу, действующую на единицу длины контура поверхности и стремящуюся сократить поверхность до минимума при заданных объемах фаз. Работа образования новой поверхности затрачивается на преодоление сил межмолекулярного сцепления ( когезии) при переходе молекул вещества из объема тела в поверхностный слой. Равнодействующая межмолекулярных сил в поверхностном слое не равна. Для подвижных жидкостей поверхностное натяжение - величина, тождественно равная свободной поверхностной энергии. Благодаря поверхностному натяжению жидкость при отсутствии внешних воздействий принимает форму шара, обеспечивая минимальную площадь поверхности и минимальное значение свободной поверхностной энергии. [7]
Колебательные спектры экспериментально наблюдаются как ИК-спектры и спектры комбинационного рассеяния. Эти два вида спектров имеют различную физическую сущность. ИК-спектры наблюдаются в результате разрешенного правилами отбора перехода молекулы вещества с одного энергетического уровня на другое. В коррозионных исследованиях обычно имеют дело с наблюдаемыми ИК-спектрами поглощения, получаемыми в результате перехода молекулы с уровня, имеющего меньшую энергию, на уровень с большей энергией. Спектры комбинационного рассеяния возникают при электронной поляризации, вызванной воздействием ультрафиолетового или видимого излучения. [8]
Как уже было показано в гл. V, вещества с молекулярной решеткой и низкой полярностью обладают малой растворимостью в воде, но хорошо растворяются в органических растворителях. Причина состоит в том, что для перехода молекул вещества в воду им нужно затратить дополнительную энергию для разрушения структуры воды. При контакте такого раствора с органическим слабополярным растворителем, который практически не структурирован, вещество переходит из водной в органическую фазу, так как это состояние соответствует более низкой энергии в системе. Образно говоря, наблюдается выталкивание молекул вещества из структурированного растворителя ( воды) в органический растворитель. [9]
Понижение температуры замерзания раствора можно объяснить подобно тому, как мы объясняли повышение температуры кипения. На рис. 18 - 13, а схематически изображена чистая жидкость В в равновесии с чистым кристаллическим твердым веществом В; при этом молярная свободная энергия вещества В в обоих фазах одинакова. Многие столкновения оказываются безрезультатными. Однако скорость перехода молекул вещества В из кристаллической фазы в жидкую фазу остается без изменений. Свободная энергия перехода вещества В из одной фазы в другую оказывается ниже для жидкости, чем для кристалла, а равновесие смещается в сторону плавления. Часть кристаллического вещества должна расплавиться ( или раствориться) в жидкости. Вот почему СаС12 или NaCl, разбрасываемый на скользких зимних дорогах, расплавляет лед. [11]
Страницы: 1
