Переход - кратная связь
Cтраница 2
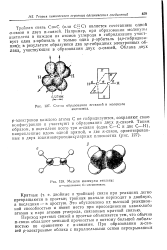 |
Схема образования я-связей в молекуле ацетилена.| Модели молекулы этилена. [16] |
Переход кратных связей в простые объясняется тем, что обычно л-связи обладают меньшей прочностью и поэтому большей лабильностью по сравнению с о-связями. [17]
 |
Схема образования л-связи в молекуле этилена.| Схема образования л-связей в молекуле ацетилена. [18] |
Переход кратных связей в простые объясняется тем, что обычно я-связи обладают меньшей прочностью и поэтому большей лабильностью по сравнению с о-связями. [19]
 |
Термодинамические параметры некоторых октанов ( в ккал / моль. [20] |
Однако переход кратной связи от третичного углерода к вторичным или, тем более, к первичным углеродным атомам сопровождается значительным возрастанием свободной энергии олефинов. В связи с этим понятно, что среди разветвленных продуктов изомерных превращений должны в значительной степени преобладать непредельные углеводороды с кратной связью при третичном углеродном атоме. [21]
Реакции полимеризации, обусловленные переходом кратных связей в одинарные в результате перестройки it - связей, дают нам очень большое количество ценных полимерных материалов. [22]
Реакции полимеризации, обусловленные переходом кратных связей в одинарные в результате перестройки л-связей, дают нам очень большое количество ценных полимерных материалов. [23]
Реакции полимеризации, обусловленные переходом кратных связей в одинарные в результате перестройки п-связей, дают нам очень большое количество ценных полимерных материалов. [24]
Это связано, между прочим, и с большим изменением свободной энергии перехода кратной связи при вторичных углеродных атомах циклогексена в кратную связь при третичном углероде 1-метил-цикло - пентена-1. [25]
Кинетика, а в ряде случаев и природа одного из важнейших в практическом отношении процессов химической технологии - полимеризации органических мономеров - существенно изменяются под действием излучения. Как правило, полимеризация заключается в переходе кратных связей мономеров в одинарные связи полимеров. Очевидно, что подобные процессы характеризуются большей или меньшей энергией активации. Обычно для осуществления цепной реакции полимеризации реакционную среду - подвергают действию видимого УФ-света либо вводят различные катализаторы, благодаря чему в сфере полимеризации образуется некоторое количество свободных радикалов. [26]
Производные циклических кетонов в тех же условиях образуют 2 3-циклоалкенопиридины. VII) с выходами 35 и 33 % соответственно получены 2 3-циклопентено - 6-этилпиридин и 2-этилхинолип. Реакции 1 4-циклопри-соединения в этих случаях, по-видимому, предшествует смещение всех кратных связей имина, включая довольно редкий переход кратной связи из CN - в СС-положение. [27]
Введение в молекулу кратной связи обычно сообщает ей склонность к реакциям присоединения. Это отмечают, говоря о ненасыщенном ( непредельном) характере вещества, содержащего в своем составе кратные связи. Например, простейшие непредельные углеводороды - этилен ( Н2ССН2) и ацетилен ( НС СН) - легко присоединяют галогены. Присоединение связано с переходом кратных связей между атомами углерода в простые. [28]
Химические свойства углеводородов, не имеющих кратных ( двойной или тройной) связей, в общем приблизительно повторяют свойства метана. Введение в молекулу кратной связи обычно сообщает ей склонность к реакциям присоединения. Это отмечают, говоря о ненасыщенном ( непредельном) характере вещества, содержащего в своем составе кратные связи. Например, простейшие непредельные углеводороды - этилен ( Н2С - СН2) и ацетилен ( Н - С - нС - И) - легко присоединяют галоиды. Реакция присоединения связана с переходом кратных связей между атомами углерода в простые. Сравнительная легкость такого перехода и обусловливает ненасыщенный характер соединений. [29]
Химические свойства углеводородов, не имеющих кратных ( двойной или тройной) связей, в общем приблизительно повторяют свойства метана. Введение в молекулу кратной связи обычно сообщает ей склонность к реакциям присоединения. Это отмечают, говоря о ненасыщенном ( непредельном) характере вещества, содержащего в своем составе кратные связи. Например, простейшие непредельные углеводороды - этилен ( Н2ССН2) и ацетилен ( Н - СзаС - Н) - легко присоединяют галоиды. Реакция присоединения связана с переходом кратных связей между атомами углерода в простые. Сравнительная легкость такого перехода и обусловливает ненасыщенный характер со-единений. [30]
Страницы: 1 2 3