Переход - электрод
Cтраница 1
Переход электродов с удаленных орбит на близкие происходит самопроизвольно, при этом часть энергии электронов излучается в виде квантов света. Как правило, в нормальных атомах электроны располагаются на самых близких к ядру разрешенных орбитах. Под влиянием внешних причин электроны перемещаются на более отдаленные орбиты, приобретая при этом дополнительную энергию. Атомы, в которых электроны под влиянием внешней силы перемещаются на внешние разрешенные орбиты, называются возбужденными. Возбуждение может быть вызвано нагреванием вещества или столкновением отдельных атомов. [1]
Рассмотрим переход электрода в пассивное состояние при анодной поляризации. [2]
Рассмотрим переход электрода в пассивное состояние при анодной поляризации. По анодной кривой / металл, окисляясь, посылает свои ионы в раствор. Анодная кривая 2 выражает зависимость скорости образования окисла от потенциала, катодная кривая 2 - зависимость скорости восстановления окисла от потенциала; анодная кривая 3 относится к адсорбции, а катодная 3 - к десорбции кислорода; кривая 4 отвечает окислению гидроксила до молекулярного кислорода. [3]
 |
Поляризационная кривая растворения железа в щелочи. [4] |
В этих случаях переход электрода в активное состояние связан с концентрацией соли. Так как скорость растворения соли зависит от ее концентрации в растворе, то при высоких концентрациях соли в электролите скорость растворения пассивирующего слоя мала и пассивирование наступает при более низких плотностях тока. [5]
Как уже подчеркивалось, любой электродный процесс включает в себя хотя бы одну стадию, связанною с переходом электродов через границу раздела электрод - электролит. Электродную поляризацию, вызванную замедленным прстеканием этой стадии, целесообразно назвать электрохимическим перенапряжением ц0, поскольку именно стадия перехода электронов является собственно электрохимическим актом. Для описания этого вида перенапряжения широко используют также термины замедленный разряд ir: n перенапряжение ( электронного) перехода. Концентрационные изменения у поверхности электрода имеют лишь второстепенное значение для возникновения электрохимического и фазового перенапряжения. [6]
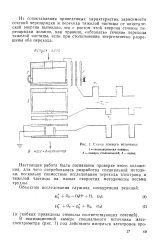 |
Схема ионного источника. [7] |
Настоящая работа была посвящена проверке этого положения, для чего потребовалась разработка специальной методики, поскольку совместные исследования перехода электрода и тяжелой частицы на малых скоростях методически весьма трудны. [8]
Из формул ( 50) и ( 54) следует: 1) кажущиеся сопротивления, измеренные потенциал - и градиент-зондами, пропорциональны истинному удельному сопротивлению среды, в которой находятся измерительные электроды; 2) величина КС изменяется пропорционально плотности тока между измерительными электродами; 3) при пересечении поверхности раздела сред потенциал-зондом величина КС изменяется плавно, так как рм и U м убывают или возрастают скачком при переходе электрода М из одной среды в другую; при пересечении поверхностей раздела различных сред градиент-зондом величина КС изменяется скачком пропорционально рмм причем отношение JnP / jnp остается практически постоянным. [9]
Время отклика электрода зависит от следующих обстоятельств. При переходе электрода [327] из одного раствора в другой на поверхности электрода остается пленка, называемая закрепленным слоем, первого раствора. Для установления нового состояния равновесия или стационарности необходимо некоторое время для миграции ионов через эту пленку. [10]
Относительно низкая химическая активность флюса положительно отражается на пониженной концентрации кислорода в наплавленном металле. Это благоприятствует переходу легирующих электродов из ленты с повышенным коэффициентом перехода в наплавляемый металл. [11]
Правда, химия элементов нулевой группы покушается и на название инертные газы, поскольку советский химик Б. А. Никитин получил соединения всех ( кроме гелия) инертных газов с водой, а также некоторые соединения с толуолом, фенолом и парахлорфенолом. Однако эти соединения носят лишь формальные признаки химических, так как они обусловлены не переходом электродов от атома к атому, а исключительно лишь молекулярными вандерваальсовыми силами. Эти соединения мало устойчивы и возможны лишь при пониженных температурах или повышенных давлениях. [12]
Это и является тормозящим коррозию действием явления поляризации. Различают анодную и катодную поляризации. Под анодной понимается поляризация, связанная с замедлением выхода ионов металла в электролит по сравнению с переходом электродов с анода на катод. Под катодной понимают поляризацию, определяемую замедлением присоединения электронов на катоде по сравнению с общим числом поступающих на катодный участок электронов. [13]
 |
Установка для снятия кривых. [14] |
В этой области протекает анодный процесс, результатом которого, как было сказано ранее, в хлоридном растворе является образование ионов меди. Вдоль этой ветви поляризационной кривой сила тока возрастает вместе с увеличением потенциала анода. Однако после того как оказывается достигнутым некоторый максимум силы тока, последующее увеличение электродного потенциала сопровождается внезапным и резким падением силы тока вследствие перехода электрода в пассивное состояние. [15]
Страницы: 1 2