Переход - первый электрон
Cтраница 1
 |
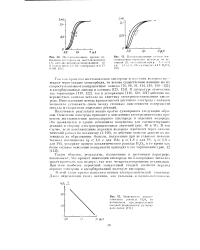
Поляризационные кривые восстановления кислорода на сажевом электроде с адсорбированной лакказой ( J и тирозиназой ( 2 в нейтральном буферном растворе. [1] |
Переход первого электрона в данной схеме является быстрым. Он может способствовать упрочнению комплекса и облегчать его протонирование. [2]
 |
Технологическая схема производства адипонитрила гидроди-меризацией акрилонитрила. [3] |
Анион-радикал ( II), возникающий при переходе первого электрона, стабилизирован в результате сопряжения нечетного электрона с л-электронами кратной углерод-углеродной связи. [4]
Таким образом, во всех случаях замедленная стадия электрохимических реакций пероксида водорода включает переход первого электрона. [5]
В случае электронного восстановления электрохимическая характеристика должна отражать способность вещества принимать на себя электроны и определять потенциал, при котором становится возможным переход первого электрона на молекулу органического вещества. Наиболее объективной характеристикой в данном случае является термодинамически обратимый окислительно-восстановительный потенциал данной реакции. Потенциал, фактически необходимый для восстановления данного вещества, кроме обратимого, включает некоторое перенапряжение, которое зависит от материала электрода и кинетики электрохимической реакции. Характерным признаком протекания электрохимической реакции по электронному механизму является наличие предельного тока на поляризационной кривой, появляющемуся из-за диффузионных ограничений по восстанавливающемуся веществу. [6]
В случае прямого электрохимического процесса электрохимическая активность органического вещества должна отражать способность его молекул принимать или отдавать электроны, а также определять потенциал, при котором Становится возможным переход первого электрона с электрода на молекулу органического вещества при восстановлении или обратный переход при окислении. [7]
В случае прямого электрохимического процесса электрохимическая активность органического вещества должна отражать способность его молекул принимать или отдавать электроны, а также определять потенциал, при котором становится возможным переход первого электрона с электрода на молекулу органического вещества при восстановлении или обратный переход при окислении. [8]
Таким образом, результаты, изложенные в настоящем параграфе, показывают, что процесс ионизации кислорода на благородных металлах может протекать как по двух -, так и по четырехэлектронному механизмам. При этом наиболее вероятной замедленной стадией является переход первого электрона к адсорбированной молекуле кислорода. [10]
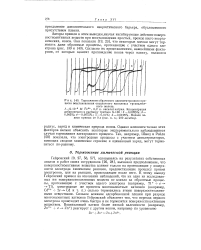 |
Торможение обратимого одноэлектронного процесса восстановления оксалатного комплекса трехвалентного железа. [11] |
Гейровский [9, 27, 56, 57], основываясь на результатах собственных опытов и работ своих сотрудников [26, 28], высказал предположение, что поверхностноактивные вещества влияют только на протекающие у поверхности электрода химические реакции, предшествующие процессу приема электронов, или на реакции, происходящие после него. Сильное влияние адсорбционной пленки при разряде многовалентных катионов Гейровский объясняет тем, что переход первого электрона происходит очень быстро и не тормозится поверхностноактивным веществом. [12]
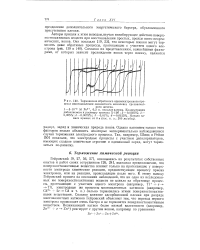 |
Торможение обратимого одноэлектронного процесса восстановления оксалатного комплекса трехвалентного железа. [13] |
Гейровский [9, 27, 56, 57], основываясь на результатах собственных опытов и работ своих сотрудников [26, 28], высказал предположение, что поверхностноактивные вещества влияют только на протекающие у поверхности электрода химические реакции, предшествующие процессу приема электронов, или на реакции, происходящие после него. Сильное влияние адсорбционной пленки при разряде многовалентных катионов Гейровский объясняет тем, что переход первого электрона происходит очень быстро и не тормозится поверхностноактивным веществом. [14]
Страницы: 1