Межмолекулярный переход - протон
Cтраница 1
Межмолекулярный переход протона в системах с сильной водородной связью регистрируется спектроскопически непосредственно по полосам ионных пар, которые существуют в равновесии с молекулярными комплексами и со свободными молекулами. Количественное исследование таких систем позволяет измерить параметры потенциальной поверхности взаимодействия АН В. [1]
Однако значительная эндотермичность процесса межмолекулярного перехода протона разрешает его осуществление только в полярных растворителях, обеспечивающих высокое значение энергии сольватации образующихся ионов, снижая тем самым энергию конечного состояния. [2]
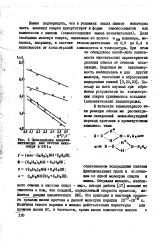 |
Оппелелеше активации для систем амин-спирт в CCV. [3] |
В качестве элементарного акта реакции обмена мы рассматриваем синхронный межмолекулярный переход протонов в промежуточном комплексе типа. [4]
Физические методы позволяют делать определенные выводы об изменении энтальпии при межмолекулярном переходе протона. Особый интерес представляют растворы кислот, в которых протон может иметь два положения: А - Н - - - В и А - - - - НВ, причем между этими формами устанавливается термодинамическое равновесие. Исследования показывают, что во всех изученных случаях ионная форма оказывается более устойчивой; в некоторых системах молекулярная форма А - Н - - В экспериментально не наблюдается и комплекс существует только в виде ионной пары. Авторы справедливо подчеркивают, что при трактовке процессов перехода протона нельзя ограничиваться одномерной моделью, но обязательно надо учитывать изменение координат всех атомов комплекса АНВ, а также реорганизацию растворителя. [5]
Физические методы позволяют делать определенные выводы об изменении энтальпии при межмолекулярном переходе протона. Особый интерес представляют растворы кислот, в которых протон может иметь два положения: А - Н - - - В и А - - - - НВ, причем между этими формами устанавливается термодинамическое равновесие. Исследования показывают, что во веет изученных случаях ионная форма оказырает-ся более устойчивой; в некоторых системах молекулярная форма А - - Н - - - В экспериментально не наблюдается и комплекс существует только в виде ионной пары. Авторы справедливо подчеркивают, что при трактовке процессов перехода протона нельзя ограничиваться одномерной моделью, но обязательно надо учитывать изменение координат всех атомов комплекса АНВ, а также реорганизацию растворителя. [6]
Полученные в данной работе результаты показывают эффективность изучения кинетики изотопного обмена водорода для установления закономерностей и механизмов межмолекулярного перехода протона в комплексах с Н - связью. Приведенная кинетическая схема позволяет качественно понять многие экспериментальные закономерности процесса, хотя ее дальнейшее развитие и уточнение требует дополнительных данных, относящихся к динамическим аспектам Н - связи. Становится ясной необходимость изучения процессов образования и распада комплексов с Н - связью, оценки факторов, определяющих роль внутренних и внешних степеней свободы в процессах образования и перестройки этих комплексов. С другой стороны, накопление экспериментальных данных по кинетике водородного обмена углубляет представление о вкладе этих элементарных стадий в процесс синхронного перехода протона. Наконец, исследование таких простейших, модельных реакций поставляет ценный материал для теории элементарного акта химического превращения. [7]
В сборнике отражено современное состояние теории строения комплексов с водородными связями, рассмотрены динамика и инфракрасная спектроскопия несимметричных и симметричных водородных связей, процессы межмолекулярного перехода протона, роль водородных связей в химических реакциях. Статьи написаны специалистами, активно работающими в соответствующих областях. [8]
Рассмотрение поверхностей потенциальной энергии систем с водородной связью позволяет не только понять основные энергетические и структурные свойства комплексов, образующихся в таких системах, но и установить закономерности одной из простейших и в то же время важнейших химических реакций - межмолекулярного перехода протона. [9]
Наличие туннельного эффекта в химических процессах с наибольшей вероятностью следовало бы ожидать в тех случаях, когда скорость реакции определяется скоростью перехода атома водорода или протона из одного положения равновесия в другое. Однако исследования протолитиче-ских реакций в последнее время [376] достаточно убедительно показали, что межмолекулярный переход протона при обычных условиях происходит над потенциальным барьером, а не путем квантовомеханического просачивания. Если бы туннельный эффект играл важную роль, то в соответствующих реакциях должны были наблюдаться, во-первых, определенные отступления от уравнения Аррениуса и, во-вторых, значительное уменьшение предэкспоненциального фактора при замене протона на дейтон. [10]
Вводная статья посвящена вопросам теории водородной связи. В ней рассмотрены природа водородной связи, закономер-нссти для колебательных частот, для межатомных расстояний, для интенсивности и ширины полос колебательных спектров. Остались неосвещенными такие важные вопросы, как влияние среды на спектры водородных связей, влияние водородных связей на межмолекулярные переходы протона, на ультрафиолетовые спектры, на колебания атомов, непосредственно не участвующих в образовании водородной связи, и многие другие. Правда, эти пробелы вводной статьи частично компенсируются другими статьями сборника. [11]
Страницы: 1