Ti-электрод
Cтраница 1
После предварительной катодной обработки Pt - Ti-электродов и многократного промывания их бидистиллятом на каждом электроде снимали неполную кривую заряжения при 12 ма и потенциодинамическую I, ф-кривую с линейной разверткой потенциала 10 мв / мин. Потенциалы приведены по отношению к обратимому водородному электроду в том же растворе. [1]
Двухстадийный характер катодной кривой восстановления реакционных продуктов Ti-электрода ( рис. 1, в) легко интерпретируется при допущении двухфазного состава и двухступенчатой схемы процесса восстановления оксида, а затем и силицида продуктов промежуточного сло я. Как можно предположить, изменение состава атмосферы с окислительного на нейтральный лишь в незначительной степени должно сказаться на характере собственно гетерофазного взаимодействия на границе титан - расплав, хотя при этом и имеют место изменения в диссоциативных процессах бесщелочного алюмоборосиликатного расплава. [2]
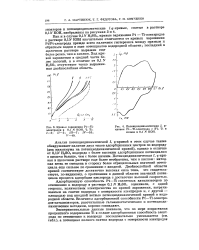 |
Кривые заряжения Pt-Ti - электродов в 0 1 N КОН, % Ti. 1 - 3. Я-5. III-7. IF-10. V-40. [3] |
Как и в случае 0 1N H2SO4, кривые заряжения Pt - Ti-электродов в растворе ОДЛГ КОН значительно отличаются от кривых заряжения Pt / Pt-электрода прежде всего наличием гистерезиса между прямым и обратным ходом в зоне потенциалов водородной области; последний в щелочном растворе выражен еще более резко, чем IB кислом. Ход кривой заряжения в средней части более пологий, и в отличие от 0 1 N HaS04 отсутствует четко выраженная двойнослойная область. [4]
На рис. 40 построение кривой скорость коррозии - потенциал выполнено по данным Р. М. Альтовского [105] для титана в растворе 40 % - ной H2S04 при 25 С. Участок кривой Е А получен по скорости коррозии Ti-электрода при разных потенциалах ( при катодной поляризации), участок кривой ADS - путем сложения реальной анодной кривой EXDS и катодной кривой ЕакКг рассчитанной по выделению водорода при анодной поляризации титана. D), довольно близко повторяет ход идеальной поляризационной кривой E DS. Можно заключить что титан в 40 % - ной H2S04находится в активном состоянии; катодным процессом является выделение водорода. Смещение потенциала от стационарного значения Ех как в положительную, так и в отрицательную сторону уменьшает скорость саморастворения титана. [5]
Страницы: 1