Перманганат - щелочной металл
Cтраница 1
 |
Схема анионной цепи в кристалле ЫаНСОз. [1] |
Перманганаты щелочных металлов по растворимости похожи на перхлораты ( VII § 6 доп. [2]
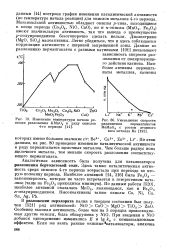 |
Изменение температуры начала реакции разложения КМпО4 в ряду окислов 4-го периода.| Уменьшение скорости. [3] |
По этим данным, на рис. 80 приведено изменение каталитической активности в ряду перманганатов щелочных металлов. [4]
Объясните, почему для бензола характерны реакции замещения и почему бензол не окисляется при действии перманганата щелочного металла в обычных условиях. [5]
Однако сами эти авторы использовали 20-минутный С11 ( вместо С14, который невозможно было получить в те годы в достаточных количествах) и исследовали процесс окисления пропионата перманганатами щелочных металлов. Можно было предполагать, что С0д - образуется из карбоксильной группы. Однако, используя карбоксильную группу, меченную по углероду, авторы показали, что только 25 % общего числа ионов СО, образуется из этой части молекулы. При окислении пропионовой кислоты бихроматом в кислой среде было найдено, что все полученное количество С02 образовывалось из группы - СООН, что свидетельствовало о наличии различных механизмов реакций в обоих случаях. Проводились исследования окисления фумаровой кислоты НООС СНСНС ООН перманганатом в кислой среде, показавшие, что НСООН, образующаяся в количестве 1 моля на моль фумаровой кислоты, во всех случаях получается при окислении одного из вторичных атомов углерода, а С02 ( 3 моля на моль фумаровой кислоты) - из углеродных атомов карбоксильной группы и других вторичных атомов углерода. [6]
Хлорид МпС12, бромид МпВг2, иодид MnJ2, сульфат MnSO4, ( трат Мп ( НОз) з, ацетат Мп ( СН3СОО) 2 марганца, а также мандаты и перманганаты щелочных металлов М2Мп04 и ММпО4 тко растворимы в воде. [7]
Оксидирование применяется преимущественно при подготовке поверхности изделий из цветных металлов. Химическое оксидирование изделий из черных металлов проводят в щелочных средах и с использованием следующих окислителей: нитратов, нитритов, хроматов и перманганатов щелочных металлов. [8]
Чистый л п - изомер дегндрохлори-руется при температуре выше температуры плавления с образованием этилена, не обладающего инсектицидными свойствами, реакция катализируется хлоридами железа ( З) и алюминия п ультрафиолетовыми лучами. Быстро дегидрохлорируется в растворе в органических растворителях под действием щелочей или органических оснований. В других случаях стабилен п инертен. На него не действуют кислоты, перманганаты щелочных металлов или водные щелочи и кислоты. [9]
Гетероциклические соединения по химическим свойствам в большей или меньшей степени сходны с соединениями бензольного ряда. Молекулы гетероциклов могут содержать сопряженные системы двойных связей с неподеленными парами электронов гетероатомов цикла ( азотом, серой или кислородом), что придает им ароматический характер. Например, для пятичленных гетероциклов характерны реакции замещения, а не присоединения. Некоторые из гетероциклов окисляются при действии перманганата щелочного металла. [10]
Термическая деструкция резины сильно ускоряется в присутствии кислорода и других окислителей. При температуре ниже - 20 С обычная резина становится хрупкой. При температуре ниже 70 С на нее не действуют концентрированные водные растворы оснований и кислот, кроме серной и азотной. Разрушают резину такие окислители, как пероксид водорода, галогены, водные растворы дихроматов и перманганатов щелочных металлов. [11]
Страницы: 1