Пероксид - натрий
Cтраница 1
Пероксид натрия образуется при сжигании натрия на воздухе или в кислороде, представляет собой бледно-желтый порошок, который плавится без разложения; очень сильный окислитель. Многие органические вещества при соприкосновении с ним воспламеняются. При взаимодействии Na2O2 с углекислым газом выделяется кислород. Эту реакцию используют в дыхательных аппаратах, применяемых пожарными и водолазами, а также для регенерации воздуха в закрытых помещениях, например на подводных лодках. [1]
Пероксид натрия Na2O2 образуется при сжигании натрия на воздухе или в кислороде. Получающийся продукт имеет слабо-желтоватую окраску, обусловленную примесью соединения NaO2, называемого над перекисью, или супероксидом, натрия. [2]
Пероксид натрия Na2O2 образуется при сжигании натрия на воздухе или в кислороде. Получающийся продукт имеет слабо-желтоватую окраску, обусловленную примесью соединения NaO2, называемого надперекисью, или супероксидом, натрия. [3]
Пероксид натрия Na2O2 образуется при сжигании натрия на воздухе или в кислороде. Получающийся продукт имеет слабо-желтоватую окраску, обусловленную примесью соединения Na02, называемого надперекисыо, или супероксидом, натрия. [4]
Пероксид натрия Na2O2 образуется при сжигании натрия на воздухе или в кислороде. Получающийся продукт имеет слабо-желтоватую окраску, обусловленную примесью соединения NaO2, называемого надперекисью, или супероксидом, натрия. [5]
Пероксид натрия Na2O2 образуется при сжигании натрия на воздухе или в кислороде. В заводских условиях его получают, нагревая металлический натрий в плоских алюминиевых чашках, помещенных в железную трубу, через которую пропускается ток воздуха, освобожденного от диоксида углерода. [6]
Пероксиды натрия Na2C2 и калия КаСЬ в присутствии капель воды воспламеняют порошки алюминия, угля и серы. [7]
Пероксид натрия, являясь сильным окислителем, разрушает большинство металлов, а также кварц и силикаты, так как представляет собой сильную щелочь и поэтому особенно трудно выбрать материал для тигля с хорошими свойствами по отношению к пероксиду натрия. [8]
Пероксид натрия и содержащие его смеси пригодны для разложения руд, сплавов и огнеупорных материалов, содержащих хром. Кроме того, их используют в тех случаях, если для разложения образцов, таких как шлаки, диоксид или силикат циркония и другие силикаты, не требуется окислитель. Сурьма [5.1609-5.1611] и торий [5.1612] при этом остаются в остатке. [9]
Пероксид натрия применяют в сочетании с разнообразными добавками для облегчения и ускорения полной минерализации вещества. Особое значение чистота реагента приобретает при микроопределениях кремния. [10]
Пероксид натрия представляет собой наиболее изученный, но не единственный реагент, пригодный для щелочной плавки при количественном разложении кремнийорганических соединений. Также активными разрушающими агентами являются гид-роксиды щелочных металлов, в частности гидроксиды натрия и калия, которые наиболее доступны в достаточно чистом виде. Описано несколько вариантов сплавления с NaOH и КОН применительно к анализу элементоорганических соединений. [11]
Пероксид натрия Na202 образуется при сжигании натрия на воздухе или в кислороде. Получающийся продукт имеет слабо-желтоватую окраску, обусловленную примесью соединения NaO2, называемого надперекисъю, или супероксидом, натрия. [12]
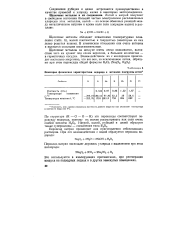 |
Некоторые физические характеристики водорода и металлов подгруппы лития. [13] |
Пероксид натрия применяют для приготовления отбеливающих растворов. [14]
Пероксид натрия Na2O2 образуется при сжигании натрия на воздухе или в кислороде. В заводских условиях пероксид натрия готовят нагреванием расплавленного натрия в токе воздуха, освобожденного от СО2, Получающийся продукт имеет слабо-жел тона-тую окраску, обусловленную примесью соединения Na02, называемого надперекисыо, или супероксидом, натрия. [15]
Страницы: 1 2 3 4