Квадратная пирамида
Cтраница 4
 |
Структура полимерных анионов ( AlFe ( а - вид сбоку и ( A1F4 - ( б - вид сверху. [46] |
Вопреки предположениям, ион 1пС15 - 2 имеют конфигурацию квадратной пирамиды, но для [ ( С6Н5) 3Р ] 21пС13 установлена конфигурация тригональной бипирамиды, аксиальные положения которой заняты атомами хлора. [47]
 |
Соединение стержней в узле. [48] |
Высота конструкции ( 2120 мм) получена как высота квадратной пирамиды со стороной основания 3 м и такой же длиной ребра. [49]
Поэтому представляется разумным, что именно пентафенилсурь-ма имеет конфигурацию квадратной пирамиды, а не аналогичные соединения мышьяка или фосфора. [50]
При этом, как видно, ион имеет конфигурацию квадратной пирамиды. В изученных ионах [ SbF5 ] 2 - и [ SbCl5 ] 2 - атом сурьмы располагается ниже плоскости четырех атомов галогенов. [51]
Для Sb ( CeH5) 5 была установлена структура квадратной пирамиды. [52]
Низкоспиновые - комплексы должны быть более устойчивыми в форме квадратной пирамиды, чем - комплексы. Это следует из того, что возбуждение от наполовину заполненной d - орбитали до заполненной осуществляется с большим трудом. [53]
Если говорить о форме ямок травления, то чаще наблюдаются усеченные квадратные пирамиды и реже октагональные. [54]
Наконец, важно указать, что геометрии тригональной бипирамиды и квадратной пирамиды действительно не сильно отличаются одна от другой, и необходимы лишь незначительные изменения углов для перехода одной в другую. [55]
В таком случае каждый атом поверхности находится в центре основания правильной квадратной пирамиды, образованной ближайшими соседними атомами. [56]
Авторы предпочитают рассматривать полиэдр как промежуточный между тригональной бипирамндой и квадратной пирамидой, принимая в последней за вершину атом Ода. В свою очередь атом С12) смещает атом NO, делая основание пирамиды не плоским. [57]
 |
Внутримолекулярный обмен лигандами ( псевдовращение в молекулах, имеющих форму тригональной бипирамиды. [58] |
Такой внутримолекулярный обмен облегчен именно тем, что тригональная бипирамида и квадратная пирамида имерт практически одинаковую стабильность и энергия активации их взаимного перехода мала. Это и понятно, так как в переходном состоянии электронные пары никогда не сближаются до валентного угла, меньшего 90, который является критическим в случае атома фосфора. [59]
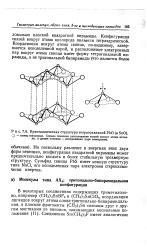 |
Кристаллическая структура тетрагональной РЬО ( и SnO. [60] |
Страницы: 1 2 3 4 5