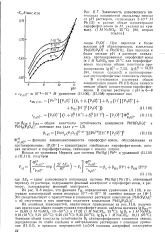
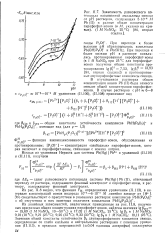
Пирофосфат-ионы
Cтраница 1
Пирофосфат-ионы являются хорошим комплексообразующим агентом, однако плохая растворимость пирофосфатов ограничивает применение их в качестве комплексообразователей. [1]
При переходе к более низким рН в растворе появлялись протонированные пирофосфат-ионы ( в I М NaNOg при 25 ЭС для пирофосфат-ионов получены общие константы про-тонирования lg Р н 7 53, Ig р 1 12 93 [ 84, первая ссылка ]) и протонированные двупирофосфатные комплексы свинца. [3]
В методе Белла после нейтрализации полифосфата аммония до рН 3 8 триполифосфат и пирофосфат-ионы осаждают сульфатом цинка. Выделившуюся серную кислоту титруют раствором едкого натра. Таким образом определяют содержание суммы пиро - и три-полифосфатов. После растворения осадка в соляной кислоте пиро-фосфат-ион осаждают сульфатом цинка, фильтруют, прокаливают и взвешивают. Таким образом определяют содержание пирофос-фата. По разности находят содержание триполифосфата. [4]
Pb ( Hg) РЬ ( II), отвечающий переходу от раствора, содержащего фоновый электролит и пирофосфат-ионы, к раствору, содержащему фоновый электролит. [6]
Если в растворе присутствуют восстановители, реагирующие с периодатом или перманганатом, их следует удалить или разрушить перед добавлением периодата. Из немногих немешающих анионов можно указать арсенат -, борат -, фторид -, перхлорат - и пирофосфат-ионы. [7]
При использовании очень прочных комплексных соединений потенциал восстановления ионов металла будет отрицательнее потенциала электроокисления гидразина и восстановление этих ионов гидразином становится невозможным. Расчеты показывают, что лигандами в растворах комплексных соединений, из которых возможно восстановление никеля гидразином, в принципе могут быть аммиак, этилендиамин, пирофосфат-ионы, анионы некоторых органических кислот. [8]
Блестящие осадки меди из пирофосфатных электролитов были получены [93] в присутствии небольшого количества ( 6 - 10 - 5 моль / л) натриевой соли 3-нафтил - 3 6-дисульфокислоты. Измерения показали, что эта добавка способствует повышению скорости осаждения меди на катоде. Облегчение процесса выделения меди, по-видимому, происходит в результате преимущественной адсорбции добавки по сравнению с пирофосфат-ионом. Адсорбируясь на электроде, добавка вытесняет с его поверхности пирофосфат-ионы. При этом улучшается структура и становятся шире диапазоны плотностей тока [ ( 0 5 - 3 5) - 102 А / м2 ], при которых получаются полублестящие и блестящие осадки на катоде. [9]
Если в растворе присутствуют восстановители, реагирующие с периодатом или перманганатом, их следует удалить или разрушить перед добавлением периодата. Хотя хлориды в малых количествах могут быть окислены периодатом, все же их лучше удалить выпариванием с серной кислотой, особенно если анализируемый раствор содержит мало марганца. Ионы Fe2, сульфиды, нитриты, бромиды, иодиды, оксалаты и другие способные окисляться вещества можно удалить или разрушить выпариванием с азотной или смесью азотной и серной кислот. Из немешающих анионов можно отметить арсенат -, борат -, фторид -, перхлорат - и пирофосфат-ионы. [10]
Мешают элементы, вызывающие появление осадков: олово ( IV), ниобий, тантал, титан, цирконий, а в больших количествах-вольфрам и даже ванадий ( V); осадки увлекают с собой некоторое количество фосфат-ионов. Висмут, торий, мышьяк ( V), хлорид - и фторид-ионы замедляют образование окрашенного соединения. Если присутствуют фторид-ионы, прибавляют в избытке борную кислоту. Восстановители должны быть предварительно окисленными. Пирофосфат-ионы не мешают анализу, что дает возможность определять этим способом фосфаты в присутствии пирофосфатов, надо только прибавить реактив в достаточном избытке. [11]
Мешают элементы, вызывающие появление осадков: олово ( IV), ниобий, тантал, титан, цирконий, а в больших количествах - вольфрам и даже ванадий ( V); осадки увлекают с собой некоторое количество фосфат-ионов. Висмут, торий, мышьяк ( V), хлорид-и фторид-ионы замедляют образование окрашенного соединения. Если присутствуют фторид-ионы, прибавляют в избытке борную кислоту. Медь и никель мешают окраской своих ионов, если измерение проводят при Я 460 ммк. Восстановители должны быть предварительно окисленными. Пирофосфат-ионы не мешают анализу, что дает возможность определять этим способом фосфаты в присутствии пирофосфатов, надо только прибавить реактив в достаточном избытке. [12]
Мешают элементы, вызывающие появление осадков: олово ( IV), ниобий, тантал, титан, цирконий, а в больших количествах-вольфрам и даже ванадий ( V); осадки увлекают с собой некоторое количество фосфат-ионов. Висмут, торий, мышьяк ( V), хлорид - и фторид-ионы замедляют образование окрашенного соединения. Если присутствуют фторид-ионы, прибавляют в избытке борную кислоту. Медь и никель мешают окраской своих ионов, если измерение проводят при X 460 ммк. Восстановители должны быть предварительно окисленными. Пирофосфат-ионы не мешают анализу, что дает возможность определять этим способом фосфаты в присутствии пирофосфатов, надо только прибавить реактив в достаточном избытке. [13]
Окись ванадия ( У) очень плохо растворяется в воде; лакмусовая бумага в этом растворе краснеет, что говорит о наличии в растворе какой-то кислоты ванадия, которую, однако, не удалось выделить в чистом виде. В щелочах V2O5 растворяется с образованием ванадатов. Из подкисленных растворов ванада-тов выпадают объемистые гелеобразные окрашенные ( от красно-желтого до красно-бурого) осадки, содержащие переменное количество воды. Гидратиро-ванная V2O5 в воде дает темно-красный коллоидный раствор; в кислотах и щелочах она растворяется с образованием солей, так называемых орто -, пиро-и метаванадатов. Орто - и пированадаты получают лишь при использовании большого избытка щелочи или при сплавлении V2O5 с гидроокисями или окисями металлов. Ортованадат-ионы VOJJ на холоду быстро переходят в пиро-ванадат-ионы V2O -, которые при нагревании в свою очередь переходят в мета-ванадат-ионы ( VO -) n, аналогичные метафосфат-ионам ( стр. В то время как метафосфат - и пирофосфат-ионы при кипячении их растворов образуют вследствие гидролиза ортофосфат-ионы, у ванадатов наблюдается обратный порядок устойчивости. Кристаллы этого соединения окрашены в желтый цвет. Ванадат аммония слаборастворим, и его используют для выделения ванадиевой кислоты из растворов. [14]
Страницы: 1